透过基因研究发现,灵芝免疫调节蛋白质(FIP-gts)是藉由胺端之胺基酸,形成双体构形结合到淋巴球 T 细胞上,造成细胞凝集,使得 T 细胞活化而形成一连串之讯息传递,并促进分泌各种细胞激素来达成免疫调节之功能。
文/许瑞祥
◎本篇原载於1998年10月《健康灵芝》第2期12~15页
灵芝自古为我国吉祥如意的象徵。灵芝的子实体则为扶正固本的珍贵药材。至1970年代灵芝经由现代化科技被大量人工栽培後,藉由西方药理学的研究模式,重新探讨灵芝的药用价值时,褪去了传说中灵芝的神秘面纱,也更印证了古籍中记载灵芝具有安神、补中、益心气、补肝气、益精气、坚筋骨、利水道、利肾气、久食轻身不老等作用。
经由过去二十年的实验动物研究证实,灵芝的萃取物中具有镇静、镇痛、镇咳、平喘、强心、保肝、降血糖、降血脂、降血压、抗过敏、抗发炎、抗肿瘤、抗衰老、抗疲劳、免疫增强等活性,而受到各国研究人员的肯定与重视,成为延迟衰老、预防慢性疾病的寄托。
灵芝属是属於真菌界(Myceteae),无鞭毛菌门(Amastigomycota),担子菌纲(Basidiomycetes),无蕈褶目(Aphyllophorales),多孔菌科(Polyporaceae)。灵芝属的主要特徵,为其具有双层细胞壁的担孢子。
目前灵芝属中在文献中虽然有300种左右,但在药理和临床的研究中只有灵芝(G. lucidum)、松杉灵芝(G. tsugae) 、薄树灵芝(G. capense)、狭长孢灵芝(G. boninense)、无柄灵芝(G. resinaceum)等红色的灵芝和紫芝(G.sinense)、日本灵芝(G. japonicum)等紫色的灵芝与树舌灵芝(G. applanatum)等少数的几个特定种类的灵芝被研究与利用【1】。
灵芝藉由强化免疫达到防癌、抗癌之效
在过去灵芝的药理研究中,抗癌活性是最早被发现的,而灵芝的多醣体被认为是抗癌活性的主要成分,但是多醣体并不能直接杀死或抑制癌细胞,而是藉由提高免疫能力来间接表现其活性,除了可以增强 T 细胞 DNA polymerase-α活性促进其 DNA 之合成而活化 T 细胞外,并可增强自然杀手细胞之能力【2】。
此外,对於单核球的巨噬细胞的作用,会使其表现出吞噬能力增强及促进一些抑制肿瘤生长的细胞激素如:间白细胞素(IL-2、IL-4)、干扰素(INF-γ)、肿瘤坏死因子(TNF-α)等的合成与释放【3】。因此藉由强化自然杀手细胞和巨噬细胞直接攻击不正常的肿瘤细胞,达到防癌、抗癌之效果。
灵芝多醣体具有抑制肿瘤活性,其主要作用是藉由提升自体免疫能力来达到抗病目的,因此藉由提供讯号而启动原本已有的能力,相当符合传统医学所谓「扶正固本」、「扶正祛邪」的观念。
此作用相当类似於西方学者所谓「生物反应修饰剂(biological response modifier, BRM)」的概念,经由增强或调控机体的免疫功能,减轻致病因素对人体的损伤,而提高人体抗病能力,达到治病、防病的目的【4】。
这些物质与一般天然抗癌药物作用机制不同,一般天然抗癌药物多是抑制细胞之DNA、 RNA及蛋白质合成,而BRM【5】通常会结合到细胞表面专一受体,经由一系列讯息传递,例如:间白细胞素(IL-2、IL-4)、干扰素(NF-γ)、肿瘤坏死因子(TNF-α)等细胞激素之增加【6-8】,或引发抗体与补体的产生,进而达到提昇免疫能力,这些BRM通称为「免疫增强剂」。
免疫增强剂包括不同来源,第一类是从微生物及天然物分离得来,天然物中 BCG【9-12】已被开发应用,OK432【13】、Lentinan【14】则是从微生物中纯化而得到;第二类是人工合成物如:muramyl dipeptide【15】;第三类是由抗癌药物中发现的如:cyclophosphamide【16】、adriamycin【17】;第四类则为目前发现之真菌类免疫调节蛋白质。
来自真菌的外源凝集素可调节免疫
灵芝具有免疫调节蛋白质,在1989年日本学者Kino等人发表自 G. lucidum 菌丝中分离而得的小分子蛋白质 LZ-8 获得证实【18】,LZ-8 的分子量约为13k,具有免疫调节和促进细胞有丝分裂的作用。
LZ-8 的发现使灵芝研究进入另一个全新的领域,同时也使灵芝的免疫调节作用再次受到注意。然而有趣的是,在一些同属於担子菌纲的真菌中,从子实体中可纯化出一些外源凝集素(lectin),有些会促进淋巴球的增殖;相反的,有些会抑制淋巴球的增殖,包括洋菇(Agaricus bisporus),分子量为64K,由四个次单元体构成,会抑制细胞增殖。
野生洋菇(Agaricus compestris)分子量为4K、草菇(Volvariella volvacea)分子量为13K、Aleuria anrantia分子量为37K、Psathyrella velutina 分子量为40K、Lactarius delicious 分子量为37K,这些外源凝集素皆具有凝集细胞之能力。
一般而言,在蕈类中外源凝激素上所结合的醣类多不相同,猴头菇(Hericium erinaceum)上的醣类是属於sialic acid结合;Laetiporus sulfurens 是属於 N-acetyl-galactosamine 结合。这些醣类可能促进细胞表面受体的结合,但其余生理活性尚未深入探讨。
外源凝集素於医学上报导具有免疫调节(immunomodulatory)及保护肝脏(hepatoprotective)活性,可能是由於共有刺激细胞增生、促进释放出些细胞激素(cytokines)及清除自由基(free radical)的功能。
由mistletoe分离出的外源凝集素,其为一种 β-galactoside 专一性的外源凝集素,不论体外(in vitro)或体内(in vivo)中皆会促进细胞激素增生。在Balb/C-老鼠的试验中,对於肿瘤移植(tumor colonization)有抑制作用,并可促进人类肿瘤坏死因子(TNF-α)、间白细胞素(IL-l)的增加,具有免疫调节能力。
经基因重组的外源凝集素共有β-galactoside结合活性,可明显抑制 autoimmune encephalomyelitis。Bolesatine 其蛋白质浓度为0.01微克/毫升时,有最强的细胞增生活性。大部分这类外源凝集素具有凝集细胞的作用,但其功能尚未清楚。
外源凝集素对於免疫调节功能方面,不同外源凝集素与不同抗体或细胞结合能力不同,如:Agaricus bisporus 会与免疫球蛋白IgA结合;bovine conglutinin 与 IgG 结合;L-selectin 促使嗜中性白血球(neutrophil)凝集;C. albicans 所纯化得 manoprotein 其可促进人类单核球细胞(monocytes)增生。
lymphotoxin(淋巴毒蛋白),是属於一种 lymphokine(细胞激素),有延迟性过敏反应作用。Ruddle 及Waksman 提到进行老鼠试验中,当抗原存在时,淋巴球 T 细胞会释放一种物质,引发淋巴细胞活化,会将相同基因型(synergenic)的老鼠胚胎纤维细胞杀死。Granger 等人称这些具有细胞毒素者为「淋巴毒蛋白」。
如 phytohemagglutinin(PHA)是一种T细胞刺激原(mitogen),淋巴毒蛋白质会增加淋巴球对 3H-thymidine 之吸收及淋巴球细胞之增生。此类淋巴毒蛋白质的生物活性常伴随着细胞激素的产生,二者具协力性遗传毒性,特别是干扰素(IFN-γ)的产生。
淋巴毒蛋白质对标的物之影响,尚未完全了解,而淋巴毒蛋白所扮演之角色仍具有争议,可能被当作 helper T 细胞所释放之物质。但又不易见到促进抗体增加,淋巴毒蛋白质可能在发炎反应中扮演重要角色,对肿瘤或被侵害的组织具有防御能力。
免疫调节蛋白普遍存在灵芝属
1990年代初,作者等开始有关灵芝来源的免疫调节蛋白质与其基因序列之分析。1994年我们由松杉灵芝(G. tsugae)菌丝体中纯化出一免疫调节蛋白质,命名为 FIP-gts (fungal immunomodulatory protein- gts),分子量约为13K,含有少量的醣类,其不但可以促进人类周边淋巴球细胞(human peripheral lymphocytes),也可以促进小白鼠脾脏细胞增生。
由细胞摄入3H-thymidine 之量与蛋白质浓度作图,可得一钟形图形,在浓度为 5 μg/ml 时,对人类周边淋巴球细胞可达到最高之增殖作用,利用 RT-PCR 方法也可证实其可促进细胞激素如间白细胞素(IL-2、IL-4)、干扰素(INF-γ)、肿瘤坏死因子(TNF-α)之表现。
免疫调节蛋白质(FIP-gts)经由蛋白酵素水解後,利用自动胺基酸分析仪(automatic protein sequencer)分析其胺基酸序列,可知含有110个胺基酸(图一),利用分子遗传技术经由序列比对,发现FIP-gts之胺基酸序列与日本人由灵芝(G. lucidum)纯化出之免疫调节蛋白质LZ-8有相同序列【19-20】。
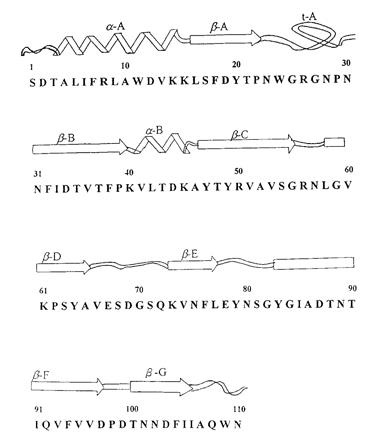
(图一) 免疫调节蛋白(FIP-gts)之胺基酸序列及结构图。(提供/许瑞祥)
由目前发表之结果显示,LZ-8 可以有效的抑制非肥胖糖尿病老鼠的自体免疫性第一型糖尿病之发生【21】,对 B 型肝炎表面抗原所引起的抗体亦有明显的抑制作用,LZ-8 也可以结合T细胞及促进细胞激素之释放【22-23】。
虽然我们从不同的灵芝菌种中,纯化出与 LZ-8 具有相同之胺基酸序列,为了了解在其他灵芝属中是否也存在着此免疫调节基因,故我们也筛选多种不同菌种的灵芝,如:G. lucidum RSH RZ-TW、G. tropicum RSH 1111-TW、G. microsporum RSH 0821-TW 及 G. formosanum RSH 0109-TW。结果令人意外的是,在这些灵芝中的确存在此免疫调节基因,而且也具有相似的基因序列。
除此之外,也抽取数十种不同菌种灵芝的基因,利用 PCR 增幅方法来筛选是否存在有此免疫调节蛋白质基因,很意外地,在将近五十株不同菌种的灵芝中,均可以得到大小相似的基因产物,至於其在真菌中扮演何种角色则尚不明了。
然而很有趣地,在一些非灵芝属的真菌类中也可纯化出免疫调节蛋白质,例如:在菇类中可由金针菇【24】及草菇纯化出一分子量约为 13K 的免疫调节蛋白质,与从灵芝纯化之 FIP-gts 大小差不多。
在其他菇类中除了金针菇及草菇外,则不存在此蛋白质,且经由胺基酸序列分析三者共有51个相同胺基酸,具有很高的相似性(图二),更有趣的是此三种免疫调节蛋白质均含有与免疫球蛋白重链的可变区域有相当之相似性。
因此,我们可以推论由灵芝、金针菇及草菇所纯化出之免疫调节蛋白质在演化上可能都是来自同一祖先,故我们也是国内最早发现不同的菌种中,也确实存在此免疫调节蛋白质基因,至於为什麽在灵芝属中都有相同的序列及其在真菌类细胞中扮演何种角色?则必须再更深入的探讨。

(图二)比较由松杉灵芝、金针菇及草菇所纯化之
免疫调节蛋白质(FIP-gts 、 FIP-fve、FIP-vvo)的胺基酸序列,
发现三者有高度的相似性。(提供/许瑞祥)
探讨灵芝免疫调节蛋白的活性来源
为了更进一步探讨免疫调节蛋白质的作用机制,我们除了从松杉灵芝菌丝体中纯化出此免疫调节蛋白质外,甚至将此免疫调节蛋白质利用遗传工程技术,藉由大肠杆菌细胞大量地表现出来,并配合分子生物之删除突变及定点突变技术,可以得到许多不同突变的突变蛋白质,用以探讨其他生理活性与此蛋白质之活性区位及作用机制,这也是利用分生研究免疫调节蛋白质(FIP-gts)作用机制的首创成果。
经由免疫细胞增生活性分析可知,重组蛋白质(FIP-gts)与由菌丝体所纯化之native FIP-gts有相同活性,在浓度为5μg/ml时有最高增殖活性。以胶体过滤方法可证实,免疫调节蛋白质(FIP-gts)在生理状态下是以双体形式存在。
同时由实验结果显示,若将胺基端删除13胺基酸,突变蛋白质除了丧失凝集细胞之能力外,同时也无法促进细胞激素间白细胞素(IL-2、IL-4)、干扰素(INF-γ)、肿瘤坏死因子(TNF-α)等之分泌与免疫增生活性有关。
综合上述结果证实,免疫调节蛋白质(FIP-gts)是藉由胺端之胺基酸形成双体构形结合到淋巴球T细胞上,造成细胞凝集,使得T细胞活化而形成一连串之讯息传递,并促进分泌各种细胞激素来达成免疫调节之功能。
开发自体免疫疾病新药
灵芝的免疫调节蛋白质除了有促进细胞增生外,也被发现对人类单核球细胞之免疫反应有抑制作用,同时也可以压制人类淋巴球细胞对同种组织移植之反应,及延长同种异体之皮肤移植的生存时间。
在我们了解免疫调节蛋白质之生理活性与作用机制後,希望将来能够利用分子模型来合成此类小分子之有机化合物,应用於临床研究上,并开发治疗自体免疫疾病及用於器官移植之新的药物。
我们从灵芝的免疫调节蛋白质 LZ-8 及基因的研发结果,开拓了另一个全新的领域。在免疫疾病束手无策的本世纪末,灵芝免疫调节蛋白质的发现,除了再次彰显灵芝丰富的内涵外,以现代最新的实验技术来检视古老的灵芝扶正固本的作用时,怎不令人对大自然造物之神奇而赞叹不已!
〔参考文献〕
1. 许瑞祥,1993,灵芝概论,万年出版社,140页。
2. Lei LS, Lin ZB. 1991. Effect of Ganoderma polysaccharides on the activity of DNA polymerase α in spleen cells stimulated by alloantigens in mice in vitro. J. Beijing Medical University, 23(4): 329-333.
3. Lieu CW, Lee SS, Wang SY. 1992. The effect of Ganoderma lucidium on induction of differentiation in leukemic U937 cells. Anticancer Research, 12 (4): 1211-1215.
4. Mizuno T, Sakai T, Chihara G. 1995. Health foods and medicinal usages of mushrooms. Food Reviews International, 11(1) : 69-81.
5. Mihich E. 1986. Future perspectives for biological response modifiers: a viewpoint. Semin. Oncol. 13: 234-254.
6. Kampschmidt RF, Pulliam LA. 1975. Stimulation of antimicrobial activity in the rat with leukocyte endogenous mediator. J. Reticuloendothel Soc. 17: 162-169.
7. Dinarello CA. 1984. Interleukin-1. Rev. Infect Dis. 6: 51-95.
8. Dinarello CA, Cannon JG, Mier JW, Bernhein HA, LoPreste G. 1986. Multiple biological activities of human recombinant interleukin-l. J. Clin. Invest. 77: 1734-1739.
9. Baldwin RW, Byers VS. 1980. Immunoregulation by bacterial organisms and their role in the immunotherapy of cancer. In: Chedid L, Miescher PA, Mueller-Eberhard HJ (eds.): Immunostimulation. Berlin, Springer-Verlag, pp. 73-94.
10. Van’t Wout JW, Poell R, Van Furth R. 1992. The role of BCG/PPD-activated macrophages in resistance against systemic candidiasis in mice. Scand. J. Immunol. 36: 713-719.
11. Dubos RJ, Schaedler RW. 1957. Effects of cellular constituents of mycobacteria on the resistance of mice to heterologous infections. J. Exp. Med. 106: 719-726.
12. Sher NA, Chaparas SD, Greenberg LE, Bernard S. 1975. Effects of BCG, Corynebacterium parvam, and methanol-extraction residue in the reduction of mortality from Staphylococcus aureus and Candida albicans infections in immunosuppressed mice. Infect. Immun. 12: 1325-1330.
13. Shiraishi A, Mikami Y, Arai T. 1979. Protective effect of OK-432 ( a Streptococcal preparation) on experimental Candidiasis. Microbiol. Immunol. 23: 549-554.
14. Maeda YY, Chihara G. 1971. Lentinan, a new immuno-accelerator of cell mediated responses. Nature 229: 634-637.
15. Zidek Z, Frankova D, Masek K. 1993. Some cellular and pathophysiological correlates of the inflammatory effects of a synthetic immunomodulatory agent, muramyl dipeptide (MDP). Agents Actions. 38: 106-115.
16. Hengst JCD, Kempf RA. 1984. Immunomodulation by cyclophosphamide. In: Mitchell MS, Fahey JL. (eds.) : Clinics in Immunology and Allergy. Immune Suppression and Modulation, Vol. 4. London, W. B. Saunders, pp. 199-216.
17. Mihich E, Ehreke MJ, Ishizuka M. 1985. Immunomodulation by antibiotics. In Mihich E, Sakurai K. (eds.) : Biological responses in cancer, vol. 3, Immunomodulation by anticancer drugs. New York, Plenum Press, pp. 71-94.
18. Kino K, Yamashita A, Yamaoka K, Watanabe J, Tanaka S, Ko K, Shimizu K, Tsunoo H. 1989. Isolation and characterization of a new immunomodulatory protein, Ling Zhi-8 (LZ-8), from Ganoderma lucidum. J. Biol. Chem. 264: 472-478.
19. Murasugi A, Tanaka S, Komiyama N, Iwata N, Kino K, Tsunoo H, Sakuma S. 1991. Molecular cloning of a cDNA and a gene encoding an immunomodulatory protein, Ling Zhi-8, from a fungus, Ganoderma lucidum. J. Biol. Chem. 266: 2486-2493.
20. Tanaka S, Ko K, Kino K, Tsuchiya A, Yamashita A, Murasugi A, Sakuma S, Tsunoo H. 1989. Complete amino acid sequence of an immunomodulatory protein, Ling Zhi-8 (LZ-8). An immunomodulator from a fungus, Ganoderma lucidum, having similarity to immunoglobulin variable regions. J. Biol. Chem. 264: 16372-16377.
21. Kino K, Mizumoto K, Sone T, Yamaji T, Watanabe J, Yamashita A, Yamaoka K, Shimizu K, Ko K, Tsunoo H. 1990. An immunomodulating protein, Ling (Zhi-8) prevents insulitis in non-obese diabetic mice. Diabetologia 33: 713-718.
22. Miyasaka N, Inoue H, Totsuka T, Koike R, Kino K, Tsunoo H. 1992. An immunomodulatory protein, Ling Zhi-8, facilitates cellular interaction through modulation of adhesion molecules. Biochem. Biophys. Res. Commun. 186: 385-390.
23. Haak-Frendscho M, Kino K, Sone T, Jardieu P. 1993. Ling Zhi-8: A novel T cell mitogen induces cytokine production and upregulation of ICAM-1 expression. Cell Immunol. 150: 101-113.
24. Ko JL, Hsu CI, Lin RH, Kao CL, Lin JY. 1995. A new fungal immunomodulatory protein, FIP-fve isolated from the edible mushroom, Flammulina velutipes and its complete amino acid sequence. Eur. J. Biochem. 228: 244-249.


