恶性黑色素瘤是皮肤癌中最危险的一种,一旦发生转移,患者的存活率将大幅下降,因此,抑制癌细胞转移就成了治疗黑色素瘤的重要关键。中山医学大学的研究证实,GMI不仅本身就对黑色素瘤细胞的移行能力有抑制作用,与新型标靶药西达本胺并用时,不仅对癌细胞的存活与移行能力有更强的抑制作用,甚至还能抑制血管新生,切断癌细胞的转移路径。动物实验也证实,GMI+西达本胺对於抑制黑色素瘤远端转移有加乘效果。
文/吴亭瑶

恶性黑色素瘤是皮肤癌的一种,主要是从分泌黑色素的黑色素细胞(例如痣)癌变而来,而过度照射紫外线(阳光)则是引发癌变最主要的危险因子。
根据维基百科的资料,在美国,病患在接受治疗後,若只有局部病变五年存活率为98%,若已发生转移,五年存活率则为17%。其他国家或地区的统计也差不多是类似概况,因此,「抑制癌细胞转移」就成了治疗黑色素瘤的重要关键。
根据中山医学大学医学系暨附设医院皮肤科主任萧玉屏医师,及同校医学研究所柯俊良教授组成的团队证实,小孢子灵芝免疫调节蛋白质GMI(Ganoderma microsporum immunomodulatory protein)不仅本身就能抑制黑色素瘤细胞生长和转移,与新型抗肿瘤标靶药物Chidamide(西达本胺)搭配使用时,还能大幅提高癌细胞凋亡的比率,并显着降低黑色素瘤在动物体内远端转移的机会。
此研究成果已於2018年6月23日的《phytomedicine》线上发表,为GMI的多重抗癌功效再添新章。
黑色素瘤细胞的移行能力,会受GMI限制
癌细胞要从原地转移到他处之前,其细胞型态会变成两端较尖的梭型,以利在组织中移动,但不管是人类黑色素瘤细胞株A375.S2,或小鼠黑色素瘤细胞株B16F10,在与GMI一起培养24小时後,其细胞型态反而有萎缩变小、变圆的趋势,尤其是对人类黑色素瘤细胞株的效果更为显着(图1)。
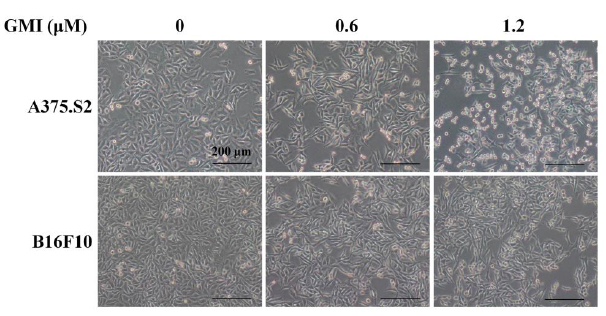
图1 GMI对黑色素瘤细胞在细胞型态上的影响
进一步以「伤口癒合试验」评估GMI是否真能降低黑色素瘤细胞的移行能力:亦即先让癌细胞长满整个培养皿,再加入不同浓度的GMI一起培养24小时,然後从中划出一道“楚河汉界”(中间不存在任何癌细胞),观察癌细胞往中间移动的状况。
结果就如图2所示,不管是人类黑色素瘤细胞株A375.S2,或小鼠黑色素瘤细胞株B16F10,没有添加GMI(剂量为0)的那组经过48小时後,癌细胞几乎把楚河汉界都盖满了;相对的,有GMI介入者,癌细胞移往中间的数量则是明显减少,显示GMI确实能降低黑色素瘤细胞的移行能力。
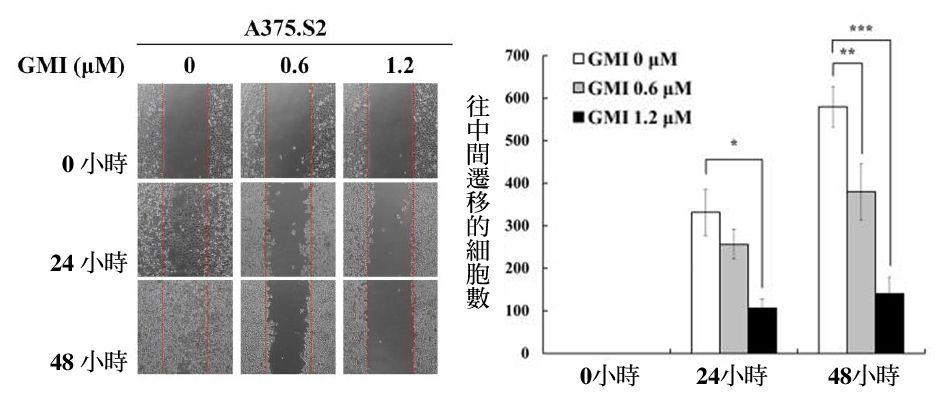
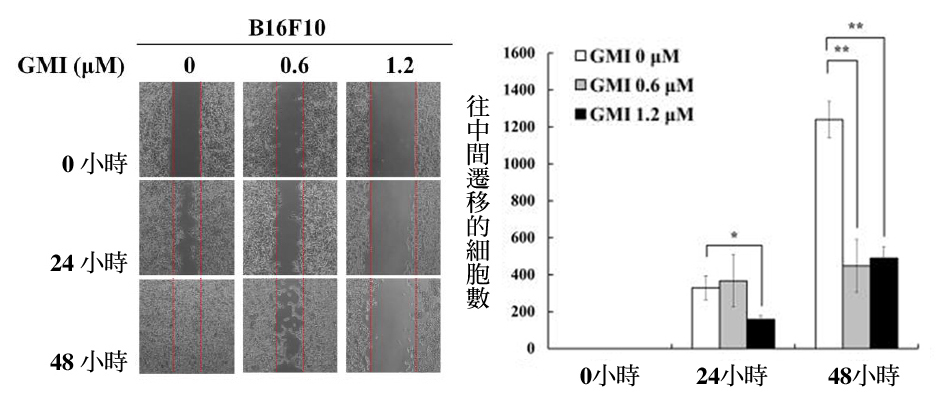
图2 GMI对黑色素瘤细胞移行能力的影响
注:上图实验采用的是人类黑色素瘤细胞株A375.S2,下图实验采用的是小鼠黑色素瘤细胞株B16F10。图中「*」、「**」、「***」表示与控制组(GMI 0μM)有统计上的显着差异性,其p值分别为<0.05、<0.01、<0.001。
GMI+西达本胺,降低黑色素瘤细胞的移行能力
研究者进一步探讨GMI搭配新型标靶药Chidamide(西达本胺)对恶性黑色素瘤的疗效。
西达本胺是一种「组织蛋白去乙醯酶抑制剂」。在癌细胞中,组织蛋白去乙醯酶(histone deacetylases; HDACs)的过度表现是一种常见现象,此酵素对於DNA的去乙醯化,会造成基因表现异常,使细胞生长失控而发生癌变。西达本胺即是透过抑制这类酵素,抑制癌细胞增生、促使癌细胞凋亡,并抑制实体肿瘤生长。
把不同浓度的西达本胺(1.25、2.5或5 μM)和GMI(0.3、0.6 μM)与人类黑色素瘤细胞株A375.S2一起培养,这样的低剂量对癌细胞并没有明显的毒杀作用,却足以降低癌细胞的移行能力。
GMI+西达本胺,抑制肿瘤血管新生
癌细胞转移的发生,除了需要癌细胞本身的移行能力,还需要从肿瘤长出血管与邻近的血管相连,癌细胞才有通道往外跑。因此研究者又以人类脐静脉内皮细胞(HUVECs)为实验对象,把它与西达本胺(0或20 μM),还有不同浓度的GMI(0、0.6、1.2 μM)一起培养24小时。
正常的人类脐静脉内皮细胞会形成类似血管的构造(事实上血管壁就是由内皮细胞形成的),然而在GMI或西达本胺的介入下,人类脐静脉内皮细胞的存活虽不会受到影响,但其形管状结构(类似血管)的能力却大为降低,而且又以GMI与西达本胺并用的效果最显着(如图3)。
此结果表明,GMI+西达本胺不仅会让恶性黑色素瘤细胞的绑手绑脚,还可能从「抑制肿瘤血管新生」下手,阻挡癌转移的发生。
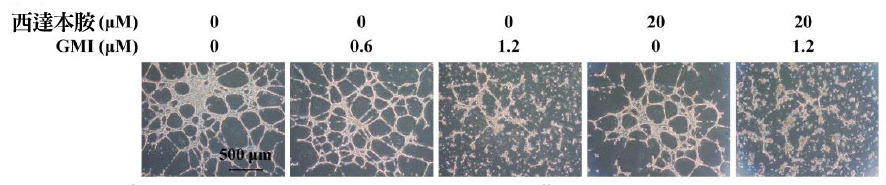
图3 GMI与西达本胺对血管新生的影响
注:图中粉红色的的部分为人类脐静脉内皮细胞形成的类似血管的管状结构。
GMI+西达本胺,提升黑色素瘤细胞的死亡率
GMI与西达本胺除了在抑制恶性黑色素瘤转移有协同作用,对於恶性黑色素瘤的存活抑制,同样也有加乘效果。
以人类黑色素瘤细胞株A375.S2的实验为例,以不同剂量的西达本胺与GMI一起处理48小时,其对癌细胞存活的抑制效果都比单用西达本胺要来得好(图4)。
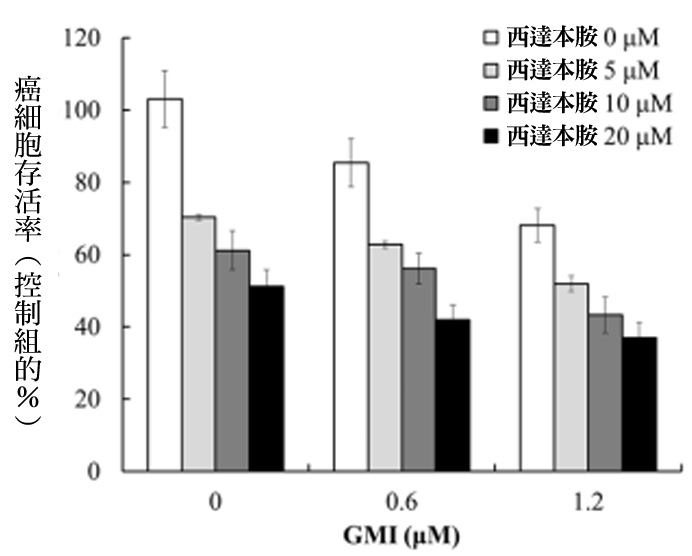
图4 GMI与西达本胺对人类黑色素瘤细胞存活的影响
再从促凋亡作用来看,人类黑色素瘤细胞株A375.S2在经过20μM的西达本胺处理24小时後,癌细胞的凋亡率连10%都不到。可是如果同时有GMI(0.6、1.2μM)一起作用,则癌细胞的凋亡率即可达到五成上下,而且也比单用GMI的效果来的好(图5),再次显示GMI与西达本胺有很好的协同作用。
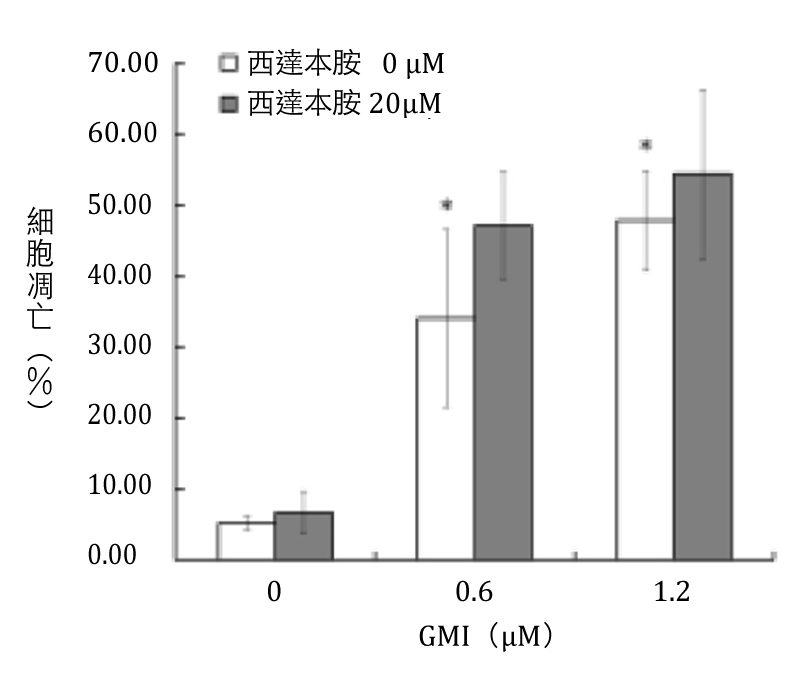
图5 GMI与西达本胺对人类黑色素瘤细胞的促凋亡作用
注:图中「*」表示与控制组(GMI 0μ)有统计上的显着差异性,p<0.05。
GMI+西达本胺,抑制黑色素瘤远端转移
实际把黑色素瘤细胞(B16F10)从尾静脉注射到小鼠体内,观察21天後癌细胞远端转移至肺脏的情况。很明显的,GMI与西达本胺并用对於癌细胞远端转移的抑制效果最显着(图6)。
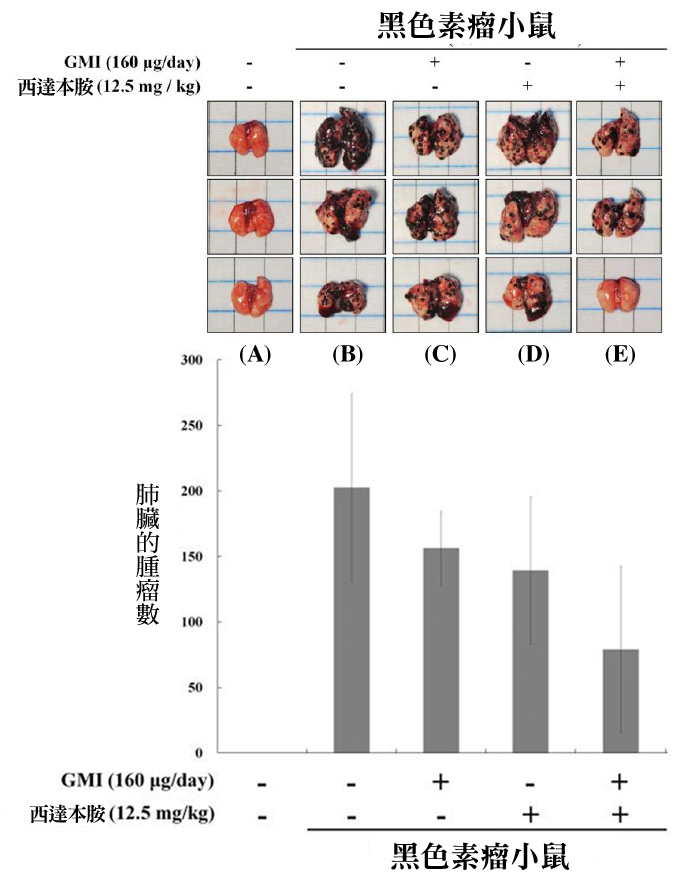
图6 GMI与西达本胺对黑色素瘤远端转移的抑制作用
〔说明〕实验小鼠分成以下五组:
(A) 正常控制组:没有接种癌细胞,亦无任何治疗介入;
(B) 肿瘤控制组:有接种癌细胞,不予任何治疗;
(C) GMI组:每天喂食160 μg的GMI;
(D) 标靶药物组:每天喂食12.5 mg/kg的西达本胺(Chidamide);
(E) GMI+免疫药物组:(C) + (D)处方。
经21天实验後,计数肺部的黑色素瘤数量。结果发现,如果不予任何治疗,从尾静脉进的癌细胞可以在小鼠肺脏长出两百颗以上的黑色素瘤;如果有GMI、西达本胺介入,则肺脏长出的黑色素瘤会明显减少,尤其以GMI+西达本胺的效果最好,能使转移至肺脏的黑色素瘤减少一半以上。
GMI+西达本胺联手抗癌的分子机制
关於GMI如何与西达本胺联手抑制恶性黑色素瘤的移行、促进黑色素瘤凋亡,研究者亦做了详细的分析(如图7),其作用机制主要与整合素(integrin)介导的讯息通路受到GMI阻挠有关。
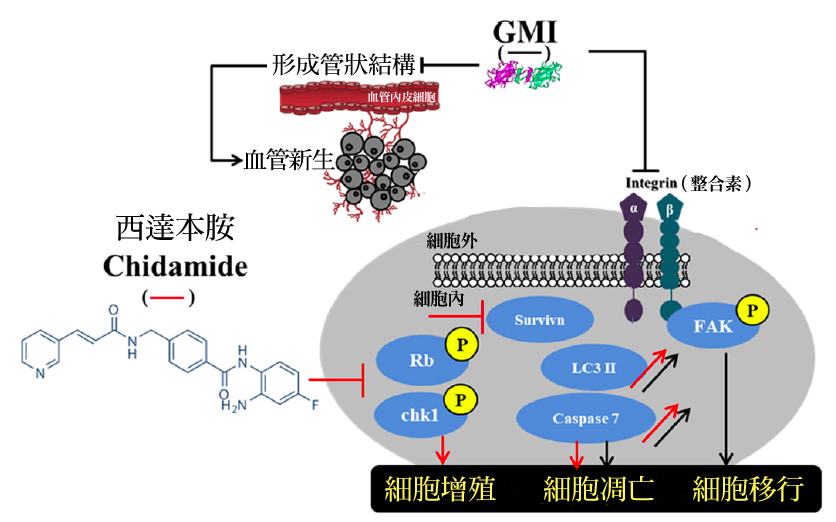
图7 GMI与西达本胺调控黑色素瘤细胞的分子机制
GMI辅助治疗,让西药可以增效减毒
上述研究成果,从细胞实验、动物实验,再到细胞分子生物实验,对GMI搭配西达本胺治疗恶性黑色素瘤的可能性,做了深入的探讨。不仅扩增GMI在抑制肺癌、乳癌、膀胱癌、口腔癌等之外的抗癌图谱,也为恶性黑色素瘤的有效治疗提供另一个新契机。
虽然免疫疗法和标靶疗法已把恶性黑色素瘤的治疗成效往前推了一大步,但不可讳言的是,昂贵的治疗费用与无可避免的副作用,仍是患者难以承担之重。
以标靶药西达本胺来说,包括血小板减少症、嗜中性白血球(中性粒细胞)减少症、癌因性疲劳、呕吐、贫血等,都是伴随西达本胺而来的副作用。至於免疫疗法,则可能引起免疫性心肌炎、丹毒样皮肤炎、内分泌疾病、皮肤瘙痒、关节炎、肝炎、肾脏相关副作用等不良反应,而且其疗效的持久性也不够理想。
因此,如果能藉由辅助治疗剂的并用,让标靶药和免疫治疗药物可以用更低的剂量(意谓更少的副作用、更低的医疗费用)发挥更好的效果,对於患者来说无疑是一大福音。本研究结果证实GMI就能扮演这样的角色,为人类抗癌增添胜算。
〔资料来源〕Lu CT, et al. Ganoderma immunomodulatory protein and chidamide down-regulate integrin-related signaling pathway result in migration inhibition and apoptosis induction. Phytomedicine (2018), doi: 10.1016/j.phymed.2018.06.023


