阳明交通大学林东毅副教授团队2022年10月底发表在《International Journal of Biological Macromolecules》的研究发现,GMI不论单独使用,或是协同第一线口服化疗temozolomide,皆能有效降低恶性胶质瘤细胞的迁移能力和生长能力,为治疗成效和患者生命带来更多可能性。
文/吴亭瑶

神经胶质瘤(glioma,也称胶质细胞瘤或胶质瘤)是最常见的「原发性」恶性脑瘤(脑癌)。它的癌变来源并非神经细胞(neuron),而是围绕在神经细胞周围,负责稳定、支持、保护神经细胞,与神经细胞以一比一的数量存在的神经胶质细胞(glial cell / glia / neuroglia)。正因为和神经细胞太接近了,所以长出来的肿瘤不仅容易压迫神经细胞、影响神经功能,也很难用手术斩草除根。
世界卫生组织根据肿瘤的组织型态和分化程度将神经胶质瘤分为四级,其中最为常见(占成人所有脑肿瘤60%),同时也是恶性度最高(第四级)、侵袭性最强的类型,就是多形性胶质母细胞瘤(glioblastoma multiforme, GBM),简称胶质母细胞瘤或恶性胶质瘤(glioblastoma)。
能够用来治疗这种脑癌的方法相当有限,即使可用的方法全都用尽,病人的存活期中位数也只有14~15个月,超过两年的机会少之又少。尤有甚者,随着治疗药物的使用和存活期的延长,原本没时间发生的癌转移,发生率也在提升当中。
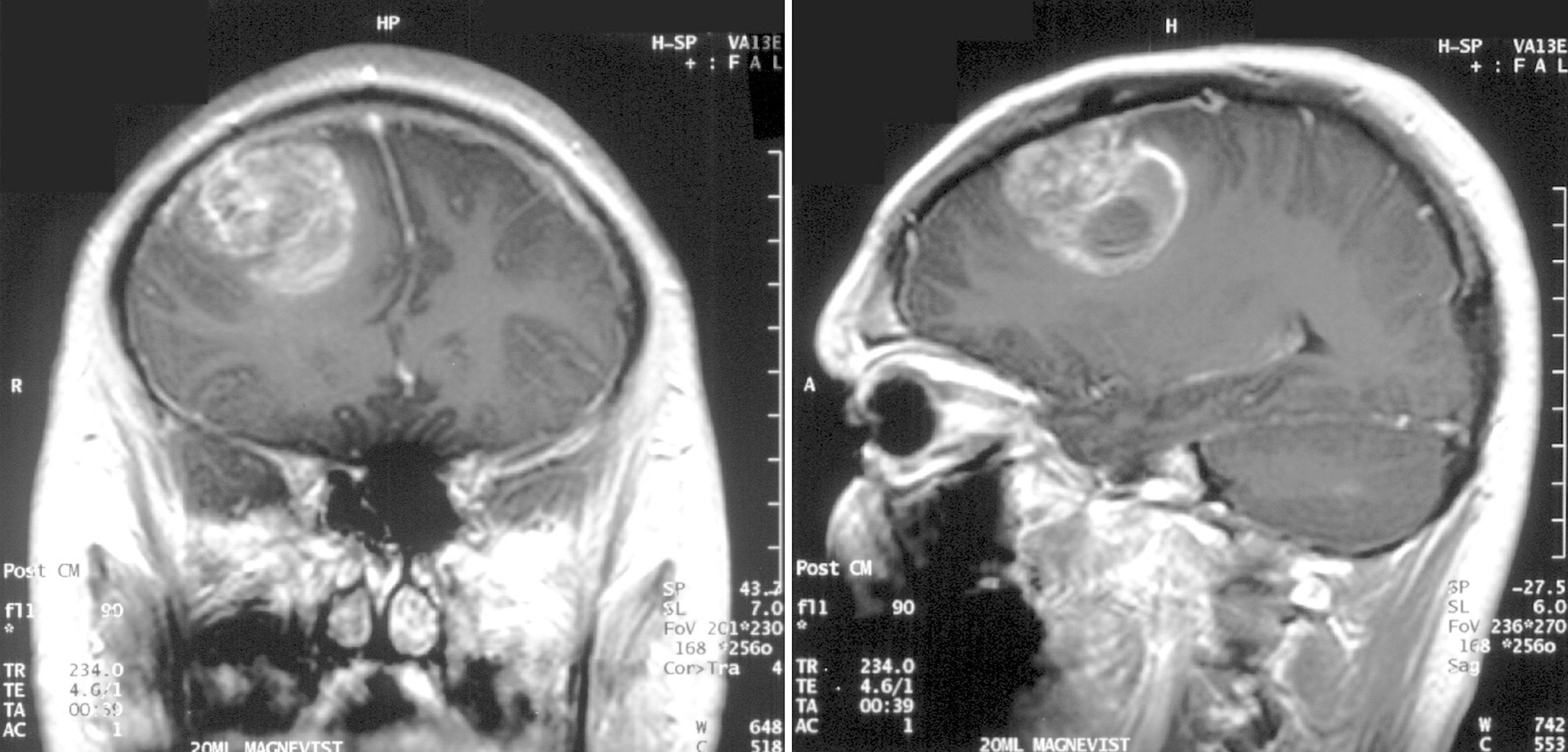
一名15岁男孩的多形性胶质母细胞瘤核磁共振(MRI)影像
(资料来源/Wikimedia Commons)
怎样才能在有限的治疗中创造更多可能性?如何才能让已经很难的生命不要变得更难?来自小孢子灵芝的免疫调节蛋白质GMI(Ganoderma microsporum immunomodulatory protein)也许是值得盼望的希望所在。
国立阳明交通大学传统医学研究所林东毅副教授团队2022年10月底发表在《International Journal of Biological Macromolecules》(国际生物大分子期刊)的研究发现,GMI不论单独使用,或是协同第一线口服化疗temozolomide(替莫唑胺,简称TMZ,商品名为Temodal®),皆能有效降低恶性胶质瘤细胞的迁移能力和生长能力,为治疗成效和患者生命带来更多可能性。
GMI抑制恶性胶质瘤细胞的迁移和侵袭
癌细胞从上方A区移动到下方B区的「迁移能力」,以及位於上方A区的癌细胞穿越中间薄膜移动到下方B区的「侵袭能力」,是体外评估癌转移的常用方法。
研究者分别把两种不同类型的人类恶性胶质瘤细胞——大量表现癌转移相关蛋白的GBM8401,或是对化疗药有抗药性的T98G——和GMI一起培养,结果发现,只需使用0.6 µM的GMI处理24小时,就能让这两种癌细胞的迁移能力和侵袭能力降低五至六成,甚至更多。
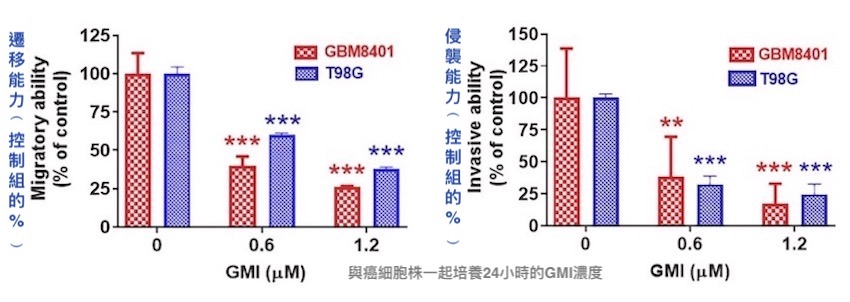
两种不同类型人类恶性胶质瘤细胞(GBM8401和T98G)
经GMI处理24小时後,迁移能力和侵袭能力均显着下降
GMI与第一线口服化疗药temozolomide有协同作用
实验还发现,把GMI(0.6 µM)和治疗恶性胶质瘤的第一线口服化疗药temozolomide(50 µM)并用,可以把化疗药抑制癌细胞迁移和侵袭的效果提升一倍以上,说明GMI与temozolomide有协同作用,两者并用没有互相抵触之虞。只不过两者协同出来的效果,几乎和单用GMI处理的效果差不多。
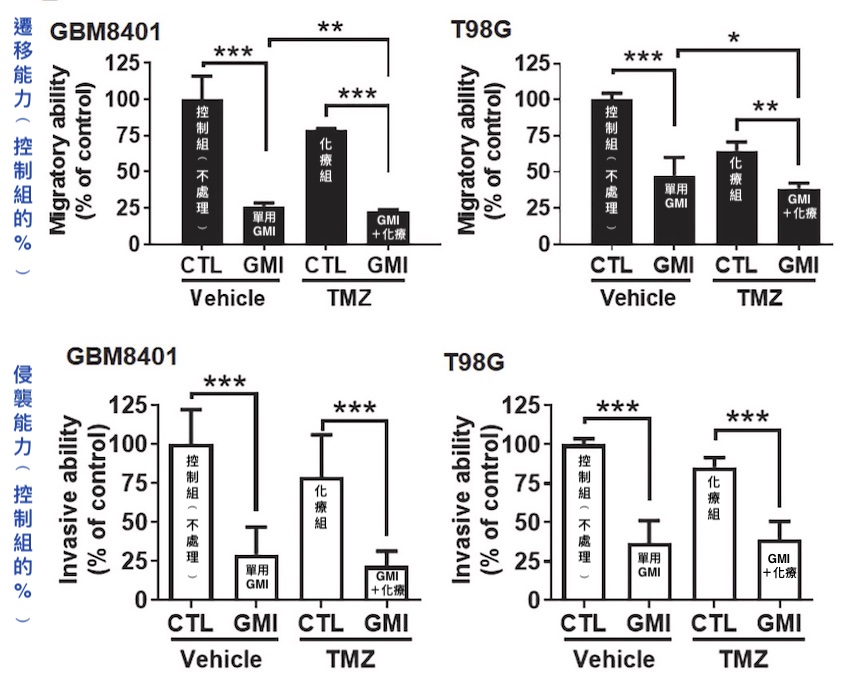
GMI能提高化疗药temozolomide(TMZ)降低恶性胶质瘤细胞
(GBM8401和T98G)的迁移能力和侵袭能力(处理时间24小时)
GMI可降低恶性胶质瘤细胞的「动能」
类似的结果也出现在另一个实验里:把恶性胶瘤细胞养满培养盘,再分别加入GMI(0.6 µM)、化疗药temozolomide(50 µM)或两者并用,然後从中划出一道楚河汉界让癌细胞分处左右两边,观察24和48小时後中间空白区域被癌细胞覆盖的面积——覆盖的面积愈大,代表癌细胞的活动能力愈强,移动速度愈快。
结果如下图所示,GMI不论单用或与化疗药temozolomide并用,都能大幅降低癌细胞的动能,而且单用GMI的效果几乎和temozolomide协同GMI相当,再次证明GMI本身就对很会乱跑的恶性胶质瘤细胞有强大的约束力。
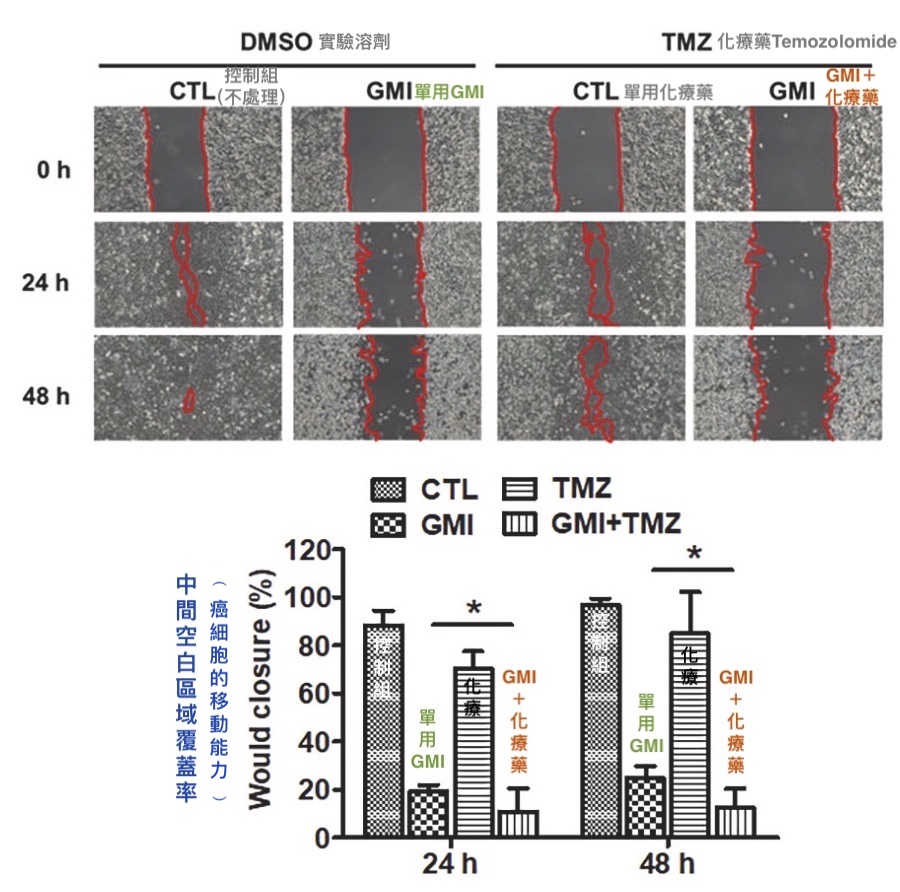
GMI不论单用或与化疗药temozolomide(TMZ)并用
都能降低恶性胶质瘤细胞(GBM8401)的移动能力
GMI「圈住」恶性胶质瘤细胞的作用机制:标靶Slug蛋白
为什麽GMI能「圈住」恶性胶质瘤细胞不让它们乱跑?研究发现,和GMI能够积极促进「Slug蛋白」降解有关。
癌细胞具备转移能量的强弱,是细胞内许多蛋白分子交互作用出来的结果。其中Slug蛋白在细胞里大量堆积,导致另一种蛋白(细胞黏附蛋白E-cadherin)的生成量减少,是癌细胞能从原本所在肿瘤脱离转移他处的关键因素。
根据本研究的实验显示,当恶性胶质瘤细胞里的Slug蛋白愈多,癌细胞之间的黏着性愈低,甚至连癌细胞存活力,以及对於化疗药temozolomide的抗药性也会跟着升高。但是如果能在恶性胶质瘤细胞(GBM8401或T98G)加入0.6 µM 的GMI一起培养,只需三小时的时间,就能让细胞内的Slug蛋白减少一大半。
进一步分析发现,GMI之所以能减少癌细胞内的Slug蛋白,并不是直接调控相关基因来降低Slug蛋白的生成量,而是让癌细胞视Slug蛋白为「不良品」,让细胞里的资源回收系统自动把Slug蛋白送去回收厂(蛋白酶体proteasome)分解。
研究者认为,GMI「标靶」Slug蛋白的作用,不仅可以用来对付大量表现Slug蛋白的肿瘤,也能提高恶性胶质瘤细胞对temozolomide的敏感性,减少抗药性的发生。
只不过,GMI这个同被美国FDA和台湾CDC认证可以天天吃也很安全的食品级膳食成分,能否以口服的方式,经由胃肠道进入血液并且穿越血脑屏障,对大脑里的恶性胶质瘤发挥抑制作用?甚或协同口服化疗药temozolomide发挥加乘效果?也许很快就有动物实验结果可以告诉我们答案。

GMI在自然状态下的立体构形与胺基酸序列
〔资料来源〕Ai-Jung Tseng, et al. GMI, Ganoderma microsporum protein, suppresses cell mobility and increases temozolomide sensitivity through induction of Slug degradation in glioblastoma multiforme cells. Int J Biol Macromol. 2022 Oct 31;219:940-948. doi: 10.1016/j.ijbiomac.2022.08.024.


