阳明交通大学林东毅副教授最新发表在《Cancer Letter》的研究发现,小孢子灵芝免疫调节蛋白质GMI会跟EGFR结合,进而触发肺癌细胞把EGFR「吞」到细胞里分解。由於跟目前临床常见标靶药物(酪胺酸激酶抑制剂)的作用机制不同,所以让GMI有机会克服标靶药物引发的抗药性问题;也因为GMI是让细胞表面的EGFR回归正常而不是完全清除,所以可以在抗癌有效性的同时,还兼具了不伤正常细胞的安全性。
文/吴亭瑶

「EGFR阳性」是一种常见於肺癌、口腔癌、大肠癌和脑癌的癌症类型,其细胞表面拥有比一般细胞更多的EGFR(表皮生长因子受体)。这些EGFR有些是野生型(也称原型,亦即尚未发生突变),需要EGF(表皮生长因子)的结合才会活化;有些则是突变型,不需外来刺激无时无刻都在自动活化。但不管EGFR的活化是被动或自动的,都会经由活化的过程打开「细胞增生」的开关,赋予癌细胞生生不息的能力。
虽然目前已有多款标靶药物可供使用,但由於癌细胞会随着治疗不断精进它的抗药能力,以致许多病人从第一代标靶药物(艾瑞莎/吉非替尼;得舒缓/厄洛替尼)吃到第二代(妥复克/阿法替尼;肺欣妥/达克替尼)、第三代(泰格莎/奥希替尼),绕了一圈最後还是又走回传统化疗的老路,或是只能放弃治疗。
所幸阳明交通大学传医药研究所林东毅副教授最新发表在《Cancer Letters(癌症快报)》的研究成果(图1)让我们知道,还有另外一种「作用机制全然不同於上述标靶药,却能有效扳倒EGFR阳性癌细胞,而且相对安全」的选择,那就是源自特定药用真菌、具有免疫调节功能的「小孢子灵芝免疫调节蛋白质GMI(Ganoderma microsporum immunomodulatory protein)」。
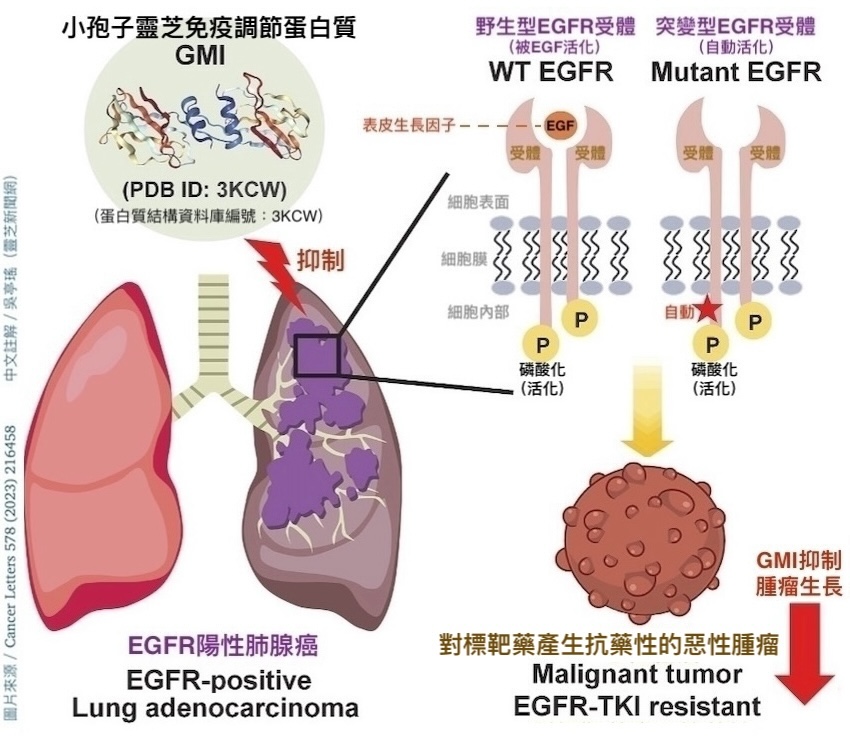
图1 GMI抑制EGFR阳性肺腺癌细胞示意图
不论EGFR突变与否,GMI都能让癌细胞自废武功
根据林东毅团队的研究,不论肺腺癌细胞的EGFR有没有发生突变,GMI都能透过「结合EGFR」的方式触发癌细胞的内吞作用,把EGFR吞到细胞里分解掉,进而让细胞表面的EGFR大幅减少(图2);少了EGFR的驱动,癌细胞的存活能力和增生能力自然也会跟着降低(图3)。
有趣的是,当研究者把同样剂量的GMI跟正常的肺细胞(表现EGFR的人类肺部纤维母细胞)放在一起培养时,不仅不影响细胞存活,对於细胞表面的EGFR数量的影响也轻微到可以忽略不计。这说明GMI对於正常细胞和癌细胞的「待遇」是有区别的,而正是这样的差别待遇让GMI的「抗癌有效性」可以跟「安全性」兼容并存。

图2 GMI可与肺腺癌细胞表面的EGFR结合
促使EGFR被癌细胞内吞而减少
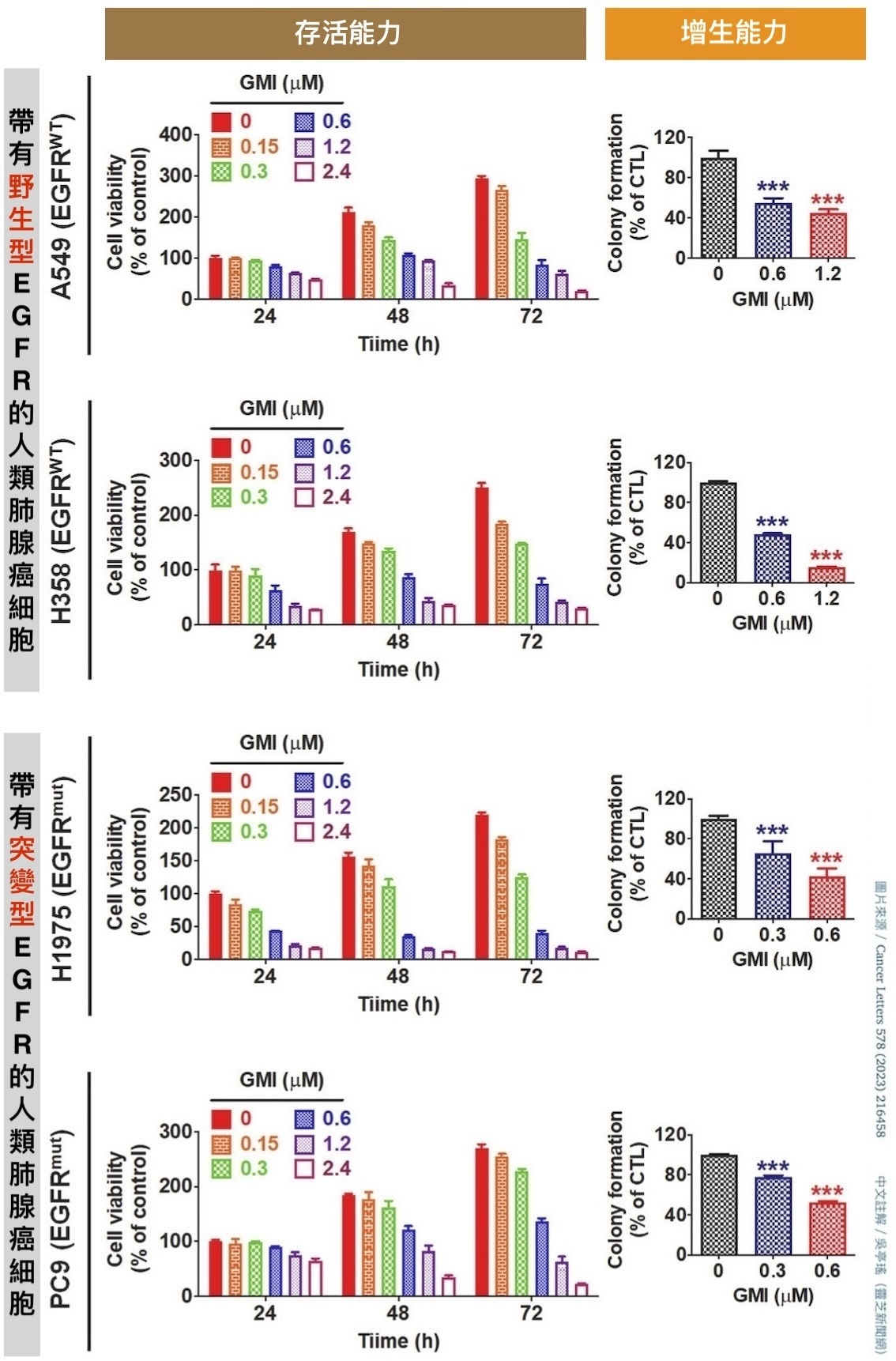
图3 GMI可抑制EGFR阳性人类肺腺癌细胞的存活能力&增生能力
【说明】本实验使用了四种不同的EGFR阳性人类肺腺癌细胞株:A549、H358、H1975、PC9。A549和H358的EGFR受体都是野生型,前者具有肺泡上皮细胞(第II型)的分化特徵,後者具有细支气管外分泌细胞(克拉拉细胞)的分化特徵。至於H1975、PC9的EGFR受体虽然都已发生突变,但突变的位置并不一样;也因为突变位置不同,造成H1975对艾瑞莎有抗药性、PC9对艾瑞莎有敏感性的差别。
不论EGFR突变与否,GMI都可在体内发挥抑瘤作用
动物实验也显示,不管是给免疫力正常的小鼠植入「EGFR野生型的小鼠肺腺癌细胞株」(图4),还是给免疫有缺陷的小鼠植入「EGFR野生型或突变型的人类肺腺癌细胞株」(图5),都能透过每三天腹腔注射一次GMI(注射到腹腔的GMI会经由腹膜微血管吸收进入血液循环)、每次注射剂量5 mg/kg的方式,减少肿瘤组织的EGFR,有效抑制肿瘤生长,而且不会对小鼠体重和肝肾功能造成负面影响(图6)。
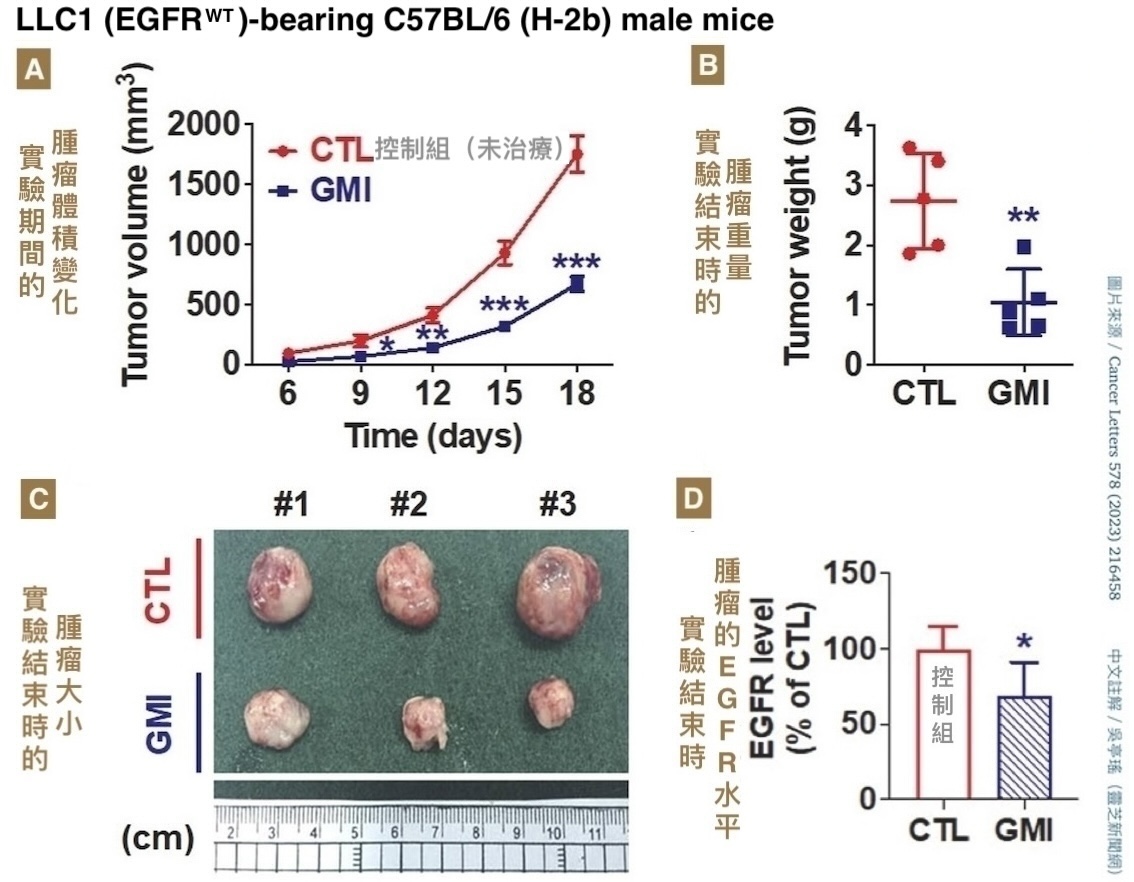
图4 GMI可在免疫正常的小鼠体内抑制
EGFR野生型小鼠肺腺癌肿瘤生长
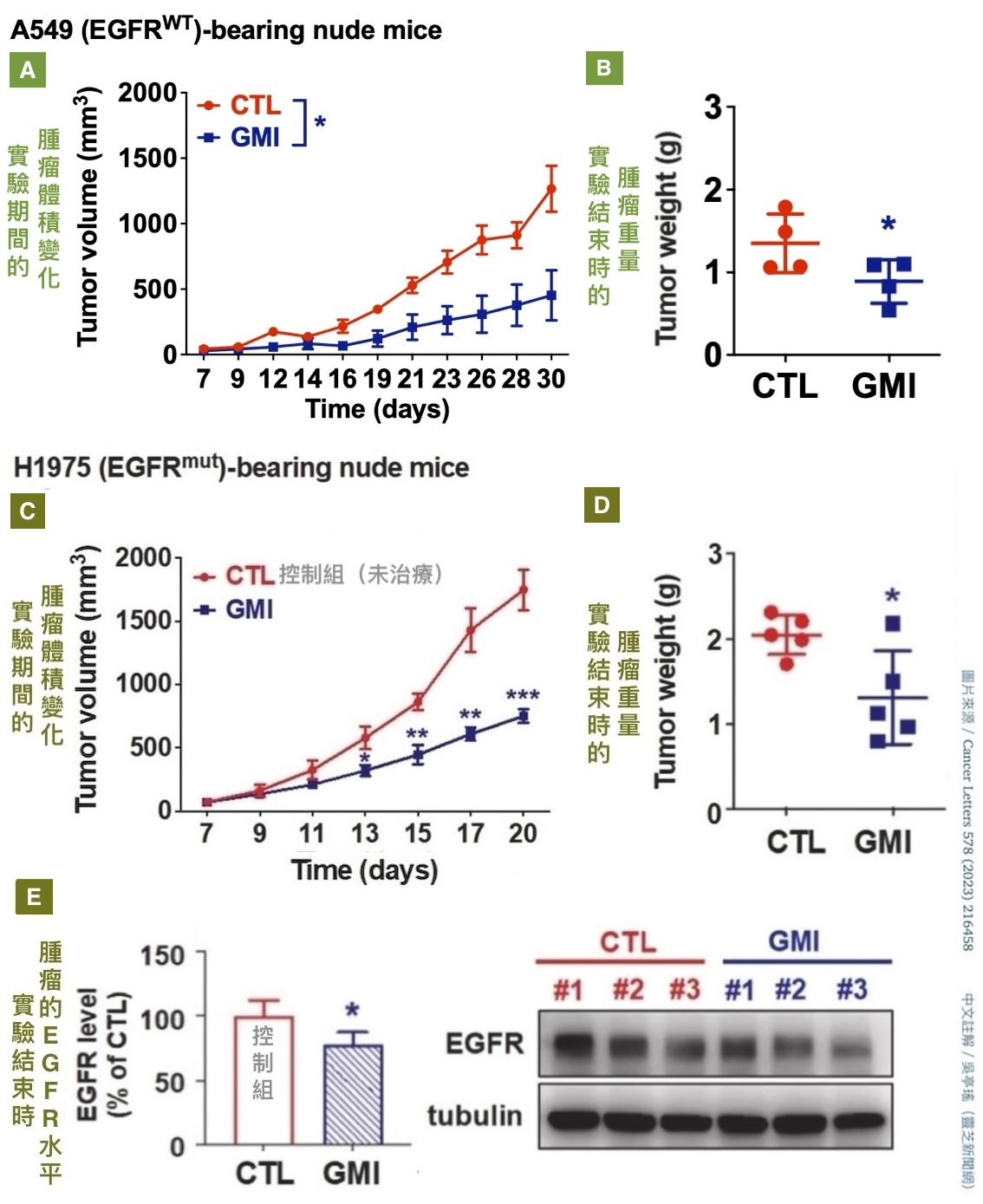
图5 GMI可在免疫缺陷的小鼠体内抑制EGFR
野生型(A-B)和突变型(C-E)人类肺腺癌肿瘤生长
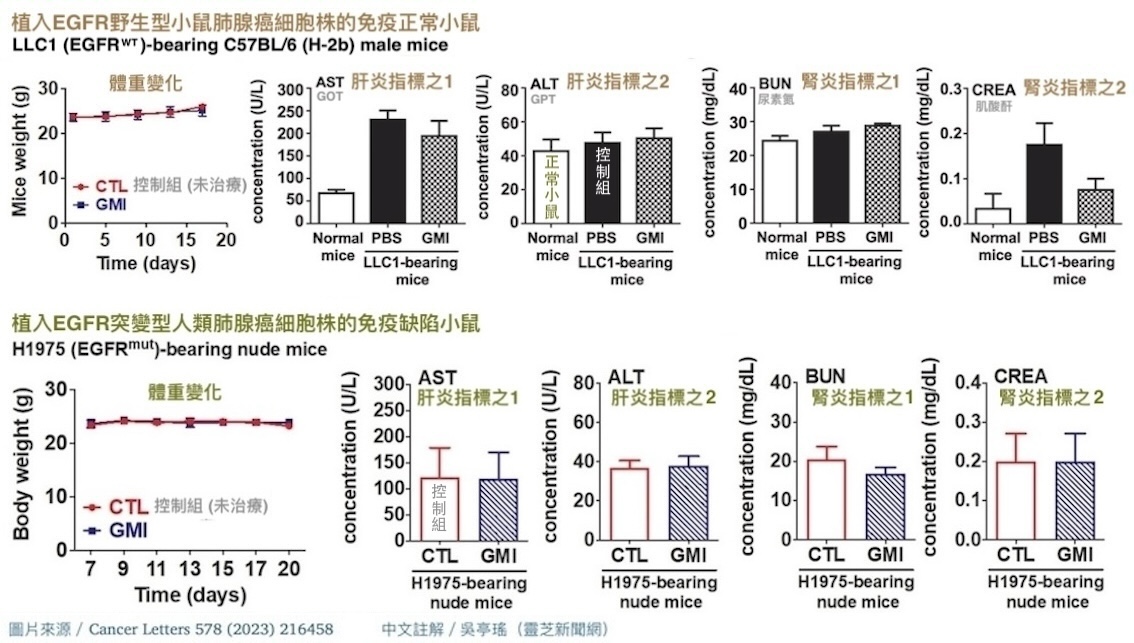
图6 GMI不会对肿瘤小鼠的体重和肝肾功能造成负面影响
GMI标靶EGFR的机制跟现有的标靶药大不相同
本研究也尝试探讨GMI的抑制作用,是否可以扩及同样过度表达EGFR但类型不同的癌细胞,结果发现,GMI对於EGFR阳性的口腔癌细胞、脑癌细胞和大肠癌细胞都有显着的抑制作用。这说明「标靶EGFR」很可能就像「调节免疫」一样,都是GMI用来维护健康的「基本配备」。
以上来自林东毅团队的研究成果,为GMI为什麽能够抑制EGFR过度表达和EGFR突变的癌细胞,提供了理论基础。不同於目前临床用来抑制EGFR突变型肺癌的标靶药物(酪胺酸激酶抑制剂)是以「阻断信号通路」的方式发挥作用(图7),GMI则是透过「结合EGFR」的方式触发癌细胞把EGFR吞到细胞里分解,(图8)。由於作用机制不同,所以GMI才有机会克服一代又一代标靶药物引发的抗药性问题。
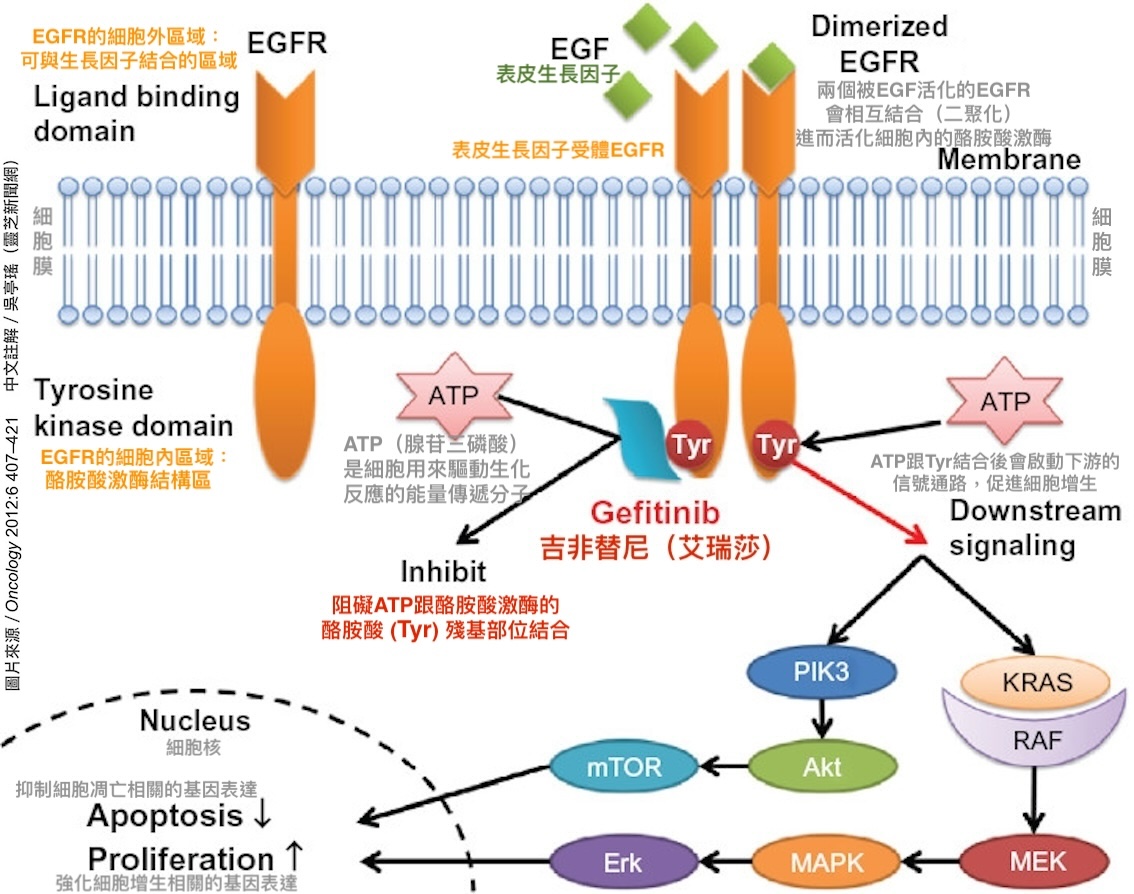
图7 EGFR标靶药「艾瑞莎」的作用机制
【说明】图中所示为第一代EGFR标靶药艾瑞莎(吉非替尼gefitinib)的作用机制。至於同为第一代EGFR标靶药的得舒缓(厄洛替尼erlotinib),以及第二代的妥复克(阿法替尼afatinib)、肺欣妥(达克替尼dacomitinib),还有第三代的泰格莎(奥希替尼osimertinib)它们的作用机制都与艾瑞莎相彷,只是结合位点不同而已。由於它们都是透过「抑制酪胺酸激酶的活性」来阻断信号通路的传递,所以这类药物也被统称为酪胺酸激酶抑制剂(Tyrosine kinase inhibitor,简称TKI)。(图片来源:https://journals.sagepub.com/doi/10.4137/CMO.S7340)
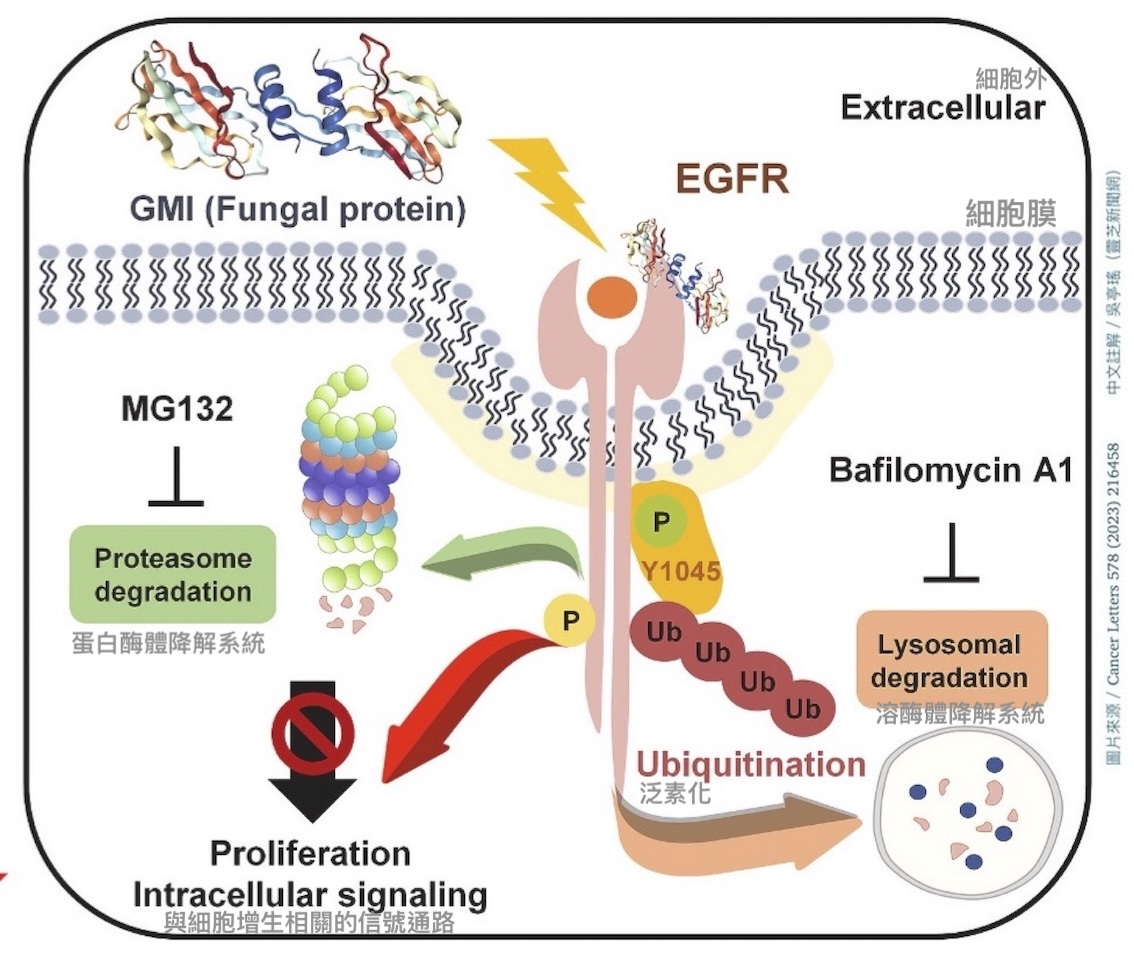
图8 GMI标靶EGFR、抑制EGFR阳性肺腺癌细胞的作用机制
【说明】当EGFR被表皮生长因子EGF活化後,会两个两个相互结合(二聚化)进而活化细胞内的酪胺酸激酶,再由活化的酪胺酸激酶启动一系列跟细胞增生相关的信号通路。当GMI与EGFR结合後,一方面会阻止EGFR二聚化,另一方面还会活化细胞内酪胺酸激酶的Y1045位点,而这个位点的活化(磷酸化)会促使细胞内一种名为「泛素」的蛋白分子给EGFR的酪胺酸激酶贴上「资源回收」的标签(泛素化)。正是这个贴标签的动作,促发了癌细胞的内吞作用,使细胞膜上的EGFR被吞到细胞里,送到「溶酶体」或「蛋白酶体」两大资源回收系统进行分解。所以才说GMI能让EGFR阳性的癌细胞透过自废武功的方式,减少细胞表面的EGFR数量,抑制癌细胞增生。
EGFR为正常的细胞增生所必需,因此「阻断信号通路」的作用机制,必然会连带影响正常细胞的生理运作;相对的,透过细胞内吞作用清除过多(但不是全部)的EGFR,让细胞表面的EGFR回到正常水平,反而像是把脱序的癌细胞拉回常轨。也许正是这种「让细胞回归正常」的机制,赋予了GMI既安全又有效的两面性;也许正是这种佛系抗癌法才能走出抗药、换药、抗药再换药的回圈,找回真正的生机。
GMI是一个成分单一、结构清楚(图9),而且可以规格化量产的灵芝活性成分。关於它的活性功效和作用机制,在众多科学家的努力下仍在不断推陈出新中。GMI把灵芝的开发应用带入了一个全新的时代。可以与西药平起平坐,甚至更胜西药一筹的灵芝新药,已经近在眼前。
图9 GMI的蛋白结构详见PDB ID: 3CKW

〔相关影片〕小孢子灵芝免疫调节蛋白GMI有效抑制EGFR表达之癌细胞
〔资料来源〕Wei-Jyun Hua, et al. Ganoderma microsporum immunomodulatory protein as an extracellular epidermal growth factor receptor (EGFR) degrader for suppressing EGFR-positive lung cancer cells. Cancer Lett. 2023 Dec 1:578:216458. doi: 10.1016/j.canlet.2023.216458.


