对於一再突变,甚至是一再对EGFR标靶药出现抗药性的突变型EGFR肺腺癌,只能换个标靶姿势再治一次,还是走回传统化疗的老路?中山医学大学医学研究所柯俊良教授率其团队成员辛翌纶博士、康于庭博士(台中荣民总医院博士後研究员)等发表在2024年12月号《Environmental Toxicology》的研究让我们看到了另一种因应的可能性,那就是既能顾前(清除EGFR)也能顾後(阻止癌细胞透过「整合素」另谋生路)的小孢子灵芝免疫调节蛋白质GMI(Ganoderma microsporum immunomodulatory protein)。
文/吴亭瑶

对前两代标靶药有抗药性的
EGFR双突变的肺腺癌细胞
简称EGFR的「表皮生长因子受体」是众多位於细胞表面的接受器之一,它可以接收多种外来信号,活化细胞内的相关分子来驱动细胞增生。正常细胞对EGFR的表现量和活性会严格调控,可是有些癌细胞会却把EGFR当成利器,将其大量表现(即所谓的EGFR阳性)加快增生速度;甚或发展出突变的EGFR,毋须等待外来信号就能自行运作,让细胞长得更快更多也更具侵袭性。
EGFR最常见的突变是L858R,意指EGFR这个蛋白的第858个胺基酸由亮胺酸(L)突变为精胺酸(R),其具体位置在EGFR位於细胞内部另一端的酪胺酸激酶区域。第一代标靶药(吉非替尼/艾瑞莎、厄洛替泥/得舒缓)和第二代标靶药(阿法替尼/吉泰瑞)均是专门针对这种突变而设计,藉由与酪胺酸激酶的活性位点结合,阻断EGFR的讯息传递,抑制细胞增生。
然而经过一段时间治疗之後EGFR通常会再次发生T790M突变,也就是第790个胺基酸从原本的苏胺酸(T)变成了甲硫胺酸(M),导致前两代EGFR标靶药无法与酪胺酸激酶的活性位点顺利结合而失去效用。本研究使用的人类肺腺癌细胞H1975就具有EGFR双突变(L858R/T790M)的特性。
(1)GMI可抑制肿瘤生长
把H1975细胞注射到裸鼠(免疫有缺陷的小鼠)右侧腹皮下组织,一周後再以口服方式每天给予160 μg GMI或生理食盐水,结果GMI组的肿瘤不只长得慢、体积小,肿瘤组织里具有活性的癌细胞也比较少【图1】。这说明GMI是一个可以经由胃肠道发挥抗肿瘤作用的活性成分,而且可以在免疫不彰的体内环境下独力抑制H1975细胞增生。

【图1】GMI对裸鼠体内的H1975细胞有抑制肿瘤生长的作用
(2) GMI可降低癌细胞的迁移能力
体外模拟细胞迁移的实验则显示,H1975细胞的迁移能力【图2-①】会在转化生长因子TGF-β诱导下变得更强【图2-③】,不过只要同时有GMI(0.3 μM)存在,不管有【图2-④】或没有【图2-②】TGF-β诱导,癌细胞从两旁移至中间无细胞区的数量均会下降,显示GMI有抑制H1975细胞迁移的作用。

【图2】GMI可在TGF-β诱导细胞迁移的环境下抑制H1975细胞迁移
对第三代标靶药有抗药性的
EGFR双突变肺腺癌细胞
学名为奥希替尼(osimertinib)、商品名为泰格莎(Tagrisso)的小分子化合物,是专门设计来对付EGFR双突变(L858R/T790M)癌细胞的第三代标靶药。与前两代标靶药类似,奥希替尼也是透过与EGFR的酪胺酸激酶区域结合(但结合位点跟前两代不同)来抑制癌细胞增生,而且也同样难以避免几个月後EGFR再次突变导致药物失效的问题。
(1) GMI可降低癌细胞的存活率
为了了解GMI是否也能对付这样的癌细胞,本研究利用H1975细胞建立了「EGFR双突变但对奥希替尼有抗药性」的人类肺腺癌细胞H1975/TR,结果发现,H1975/TR的存活率会随GMI的使用浓度与作用时间而降低【图3】,这说明GMI对H1975/TR细胞具有一定的杀伤力,也暗示GMI的作用机制有别於现有的EGFR标靶药。
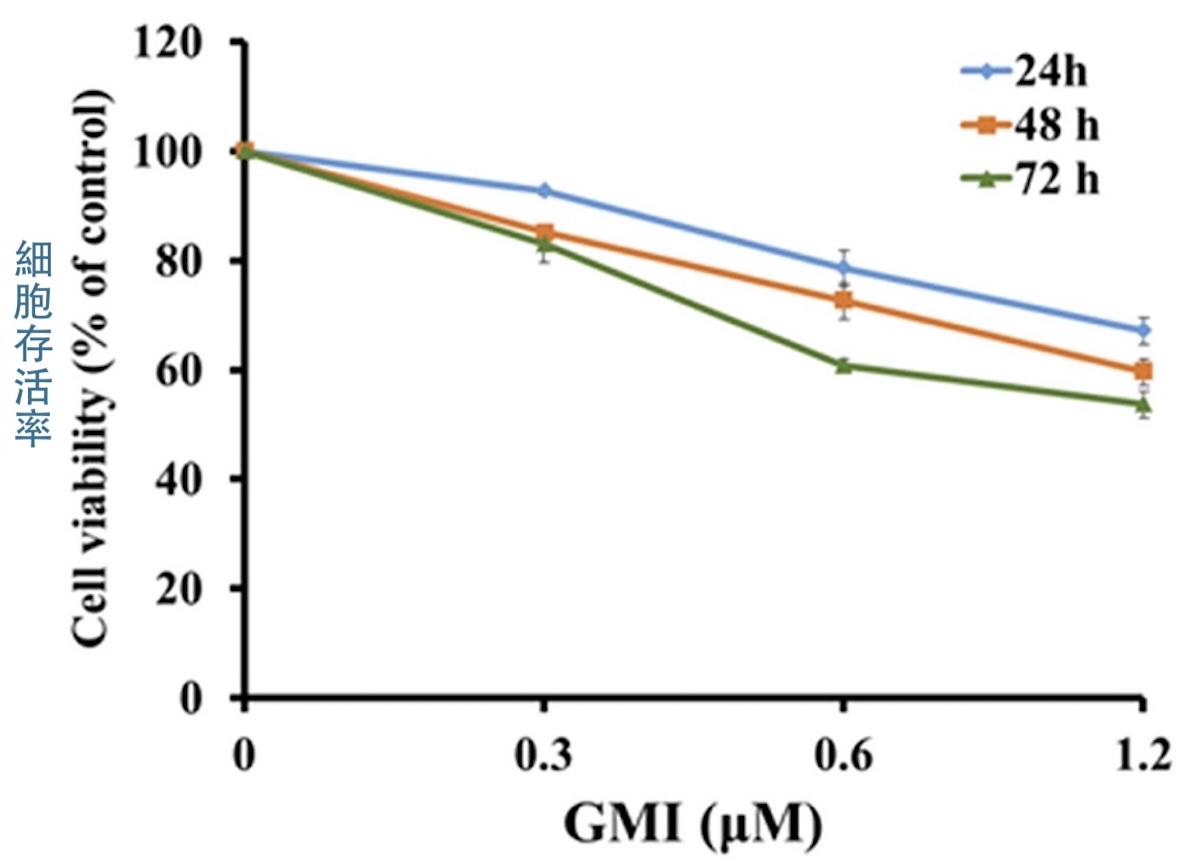
【图3】GMI能抑制H1975/TR细胞的存活率
(2) GMI能削弱癌干细胞的势力
除了透过EGFR突变让标靶药失效,癌干细胞也是抗药性的一大来源,其在整体癌细胞里的占比常与抗药性呈负相关。可是本研究的H1975/TR细胞在跟GMI一起培养12天之後,癌细胞聚集形成的肿瘤球体(tumor spheres)的数量明显少於没有GMI处理的组别【图4】。形成肿瘤球体只有癌干细胞才做得到,一般癌细胞无此能力,因此实验结果说明GMI对癌干细胞也有效——不是能够阻止一般癌细胞发获得干细胞特性,就是可以抑制既有的癌干细胞增殖。
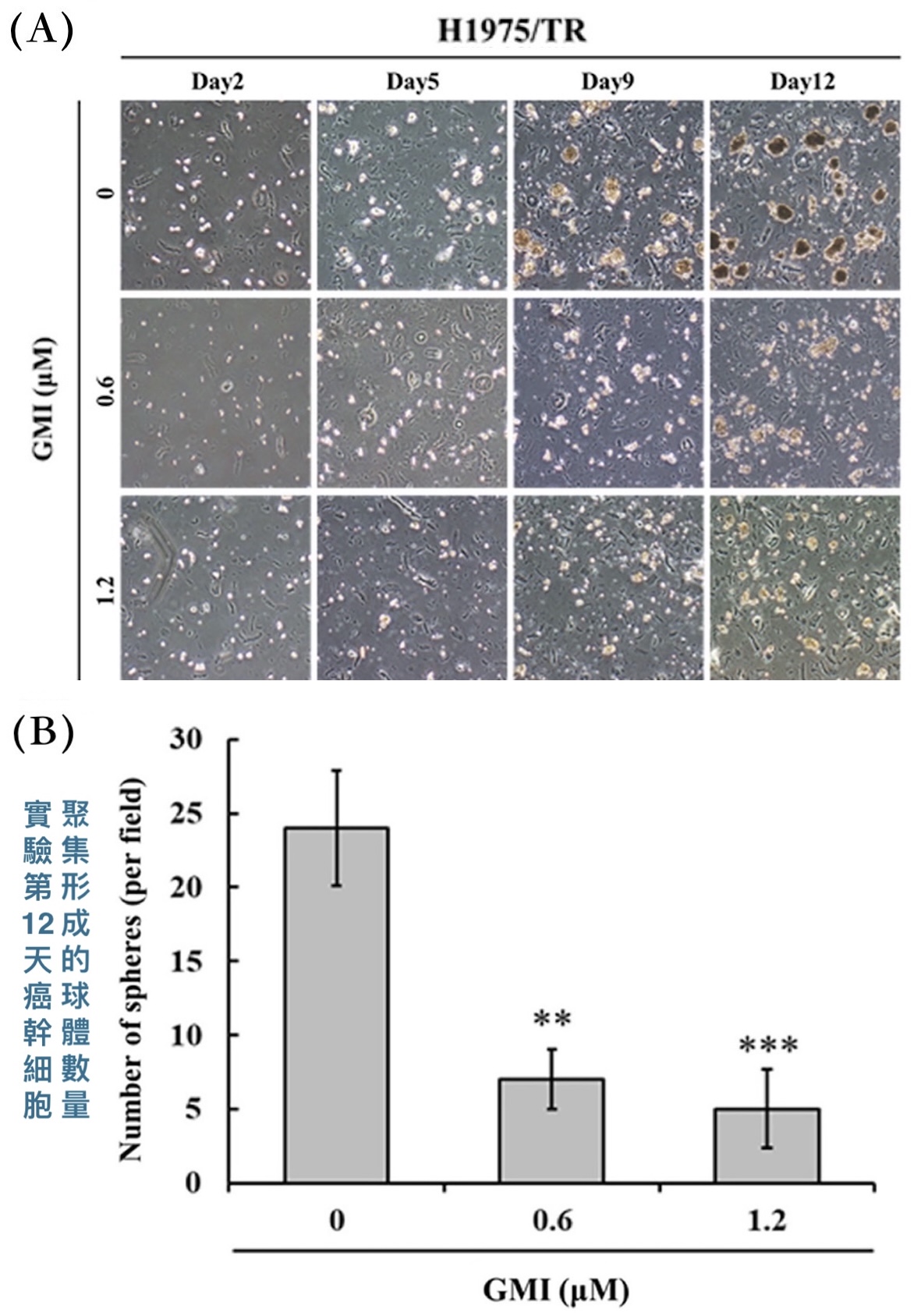
【图4】GMI能减少H1975/TR形成肿瘤球体(癌干细胞)的数量
GMI的抗癌机制:不只清除EGFR
也阻止癌细胞透过「整合素」另谋生机
癌症的本质是「细胞生长失控」。对於大量表现EGFR的肺腺癌细胞来说,EGFR就是那个造成失控的开关,因此把EGFR「卡住」,让它无法启动细胞增生相关的讯息通路,自然成为标靶药的设计核心。但也因为标靶药的药效跟EGFR的结构息相关,而癌细胞又会靠EGFR突变来挣脱束缚,使得标靶治疗宛如一场计画永远赶不上变化的结构竞赛。
相较之下,GMI化细胞生长失控为可控的做法比较像是斧底抽薪。根据本研究的实验显示,GMI不仅会让突变的EGFR从癌细胞表面消失,还会顺势清除或抑制另一群常被EGFR突变癌细胞拿来另辟蹊径而大量表达的受体——整合素(integrins)——使癌细胞无法透过这些「备用开关」继续失控地快速增生、向外迁徒(转移),甚至发展成癌干细胞【图5-7】。
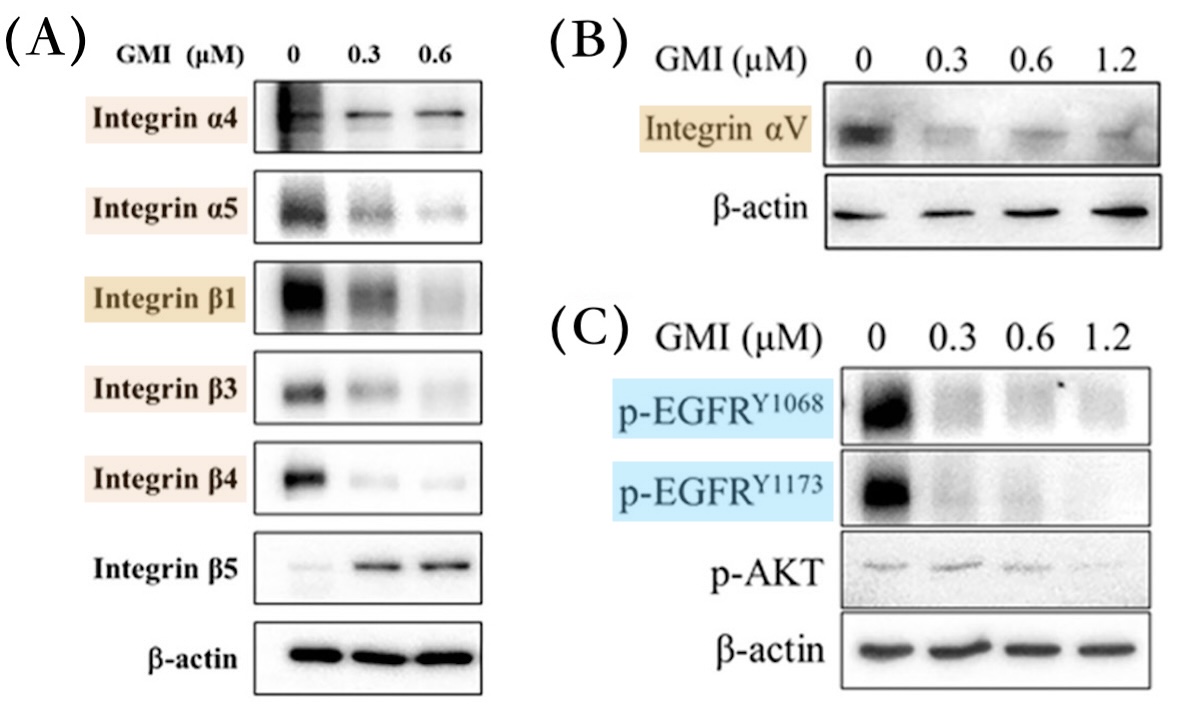
【图5】GMI可清除或减少H1975细胞的EGFR与整合素
以不同浓度GMI(0.3~1.2 μM)处理H1975细胞:
(A) 48小时後整合素α4、α5、β1、β3和β4显着减少;
(B, C) 24小时後整合素αv和突变的EGFR均尽乎消失。
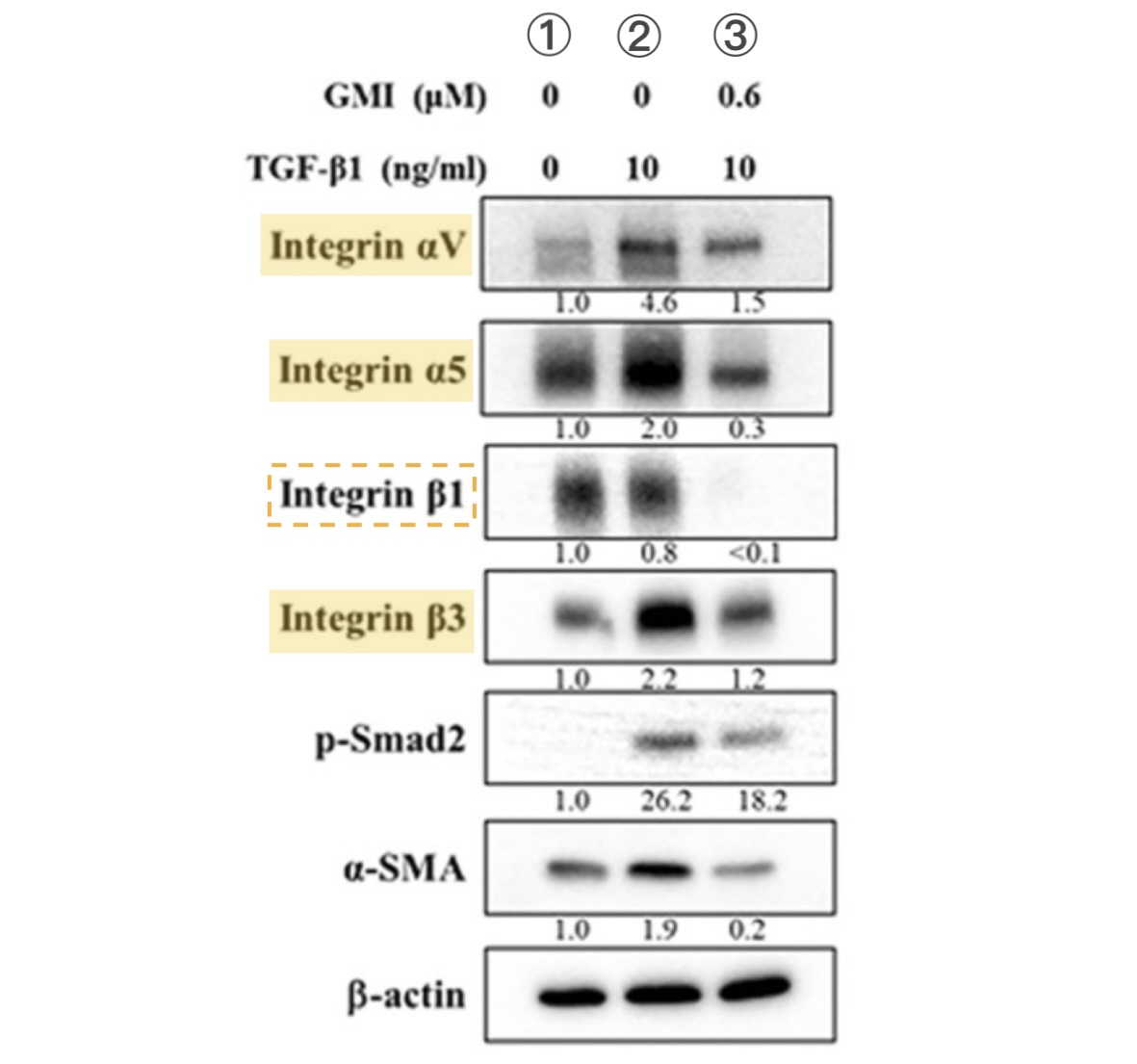
【图6】TGF-β促使H1975细胞整合素表现量增加的作用可被GMI抑制
有利细胞迁移的转化生长因子TGF-β会诱导H1975细胞
表现更多的整合素αV、α5和β3(① vs. ②),
但如果同时有GMI(0.6 μM)存在,
这些整合素只会些微幅增加甚至变少,至於仅受
TGF-β些微影响的整合素β1则完全侦测不到(③)。

【图7】GMI可清除或减少H1975/TR细胞的整合素与癌干细胞
比起H1975细胞,H1975/TR细胞会表现更多的
整合素αV和β1,细胞内部被整合素活化的FAK、
Src、Erk等分子信号也变得更强(有助细胞迁移
和癌干细胞发展),癌干细胞特有的分子标记
ALDH1A1、CD133、CD44也更显着
(表示有更多的癌干细胞)。这些指标都会在GMI
(0.3~1.2 μM)处理24~48小时之後变少或减弱。
GMI可调控不利癌患生存的整合素αV和β1,
降低其对抗药性、癌转移、癌干性的促进作用
成员众多、两两一组(α型+β型)一起工作的整合素有很多功能,除了可以像钩子一般帮助细胞稳定附着在周围组织(细胞外基质ECM),也可以像感应器那样接收周围环境的讯息来影响细胞的行为(例如增生或迁移),甚至是细胞迁移时实际负责移动的「脚」。但就如同EGFR的问题一样,本应受到严格调控的整合素却常被癌细胞过度表现,对癌症治疗带来不利的发展。
(1) 整合素αV和β1 vs. 生存期与癌干细胞
本研究根据癌症基因资料库OncoDB的数据进行分析发现,肺腺癌患者比一般人的肺组织有更高的整合素αV基因表现量;癌干细胞分子标记CD44的基因表现量,与整合素αV、β1的基因表现量都有呈正相关。此外,透过基因表达分析工具GEPIA得到的结果则显示,整合素αV和β1的mRNA表现量越高,对肺腺癌患者的生存越不利【图8】。
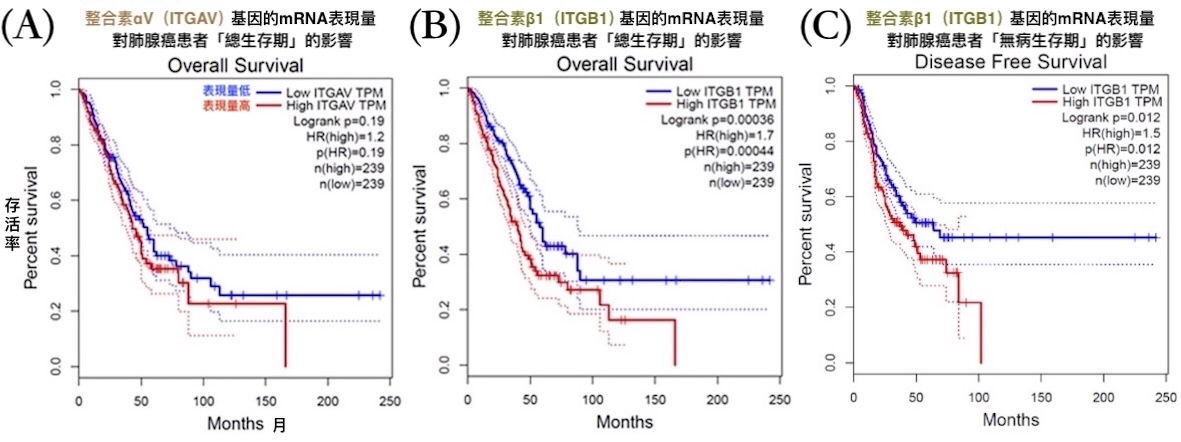
【图8】整合素αV、β1的mRNA表现量对肺腺癌患者的
总生存期(A、B)与无病生存期(C)有显着影响
「总生存期」是指从诊断或治疗开始到死亡的时间;
「无病生存期」是指治疗後无癌症复发或病变的时间。
mRNA是基因经转录作用产生的分子,
负责携带制造蛋白质(此处指整合素)的讯息,通常
mRNA表现量越高,细胞合成该蛋白质的量也越多。
(2) 整合素αV和β1 vs. 抗药性与迁移性
其他相关研究则证实,当EGFR突变的肺腺癌细胞遭受标靶药挑战时,会透过大量表现整合素αV和β1来活化细胞内部的讯息传递分子(如FAK、Src等),增强癌细胞的存活能力,使其具备抗药性【图9】。此外,肺腺癌细胞的迁移能力也跟整合素αV、β1的表现量,以及被整合素活化的FAK活性呈正相关。

【图9】EGFR突变型癌细胞藉由过度表现
整合素β1对EGFR标靶药产生抗药性示意图
EGFR标靶药都是透过跟EGFR的酪胺酸激酶结合
来发挥作用,故统称为「酪胺酸激酶抑制剂」
(tyrosine kinase inhibitor,简称TKI)。
(图片来源:https://www.mdpi.com/2072-6694/11/5/692)
(3) GMI vs. 整合素αV和β1
总的来说,整合素αV和β1不只有助EGFR突变的肺腺癌细胞产生抗药性、增强迁移性、获得癌干性,临床上还不利肺腺癌患者生存。
而在本研究里的EGFR双突变人类肺腺癌细胞,不论是对前两代标靶药有抗药性的H1975细胞,还是在TGFβ诱导下增强迁移性的H1975细胞,或是对第三代标靶药有抗药性且具有显着干细胞特性的H1975/TR,都能因为GMI介入而减少细胞表面的整合素αV、β1【图5-7】及细胞内FAK、Src、Erk分子的活性【图7】。
此作用机制【图9】对於GMI为什麽能抑制EGFR双突变肺腺癌细胞的肿瘤生长、迁移能力、生存能力和癌干细胞特性【图1-4】提供了部分解释——因为GMI能让此路不通(被EGFR标靶药阻断)而山不转路转(大量表现整合素)的癌细胞,连替代道路(整合素调控的讯息传递路径)也开通不了,或是即使开通也无法一路通畅到底(提高癌细胞获得迁移能力和干细胞特性的困难度)。
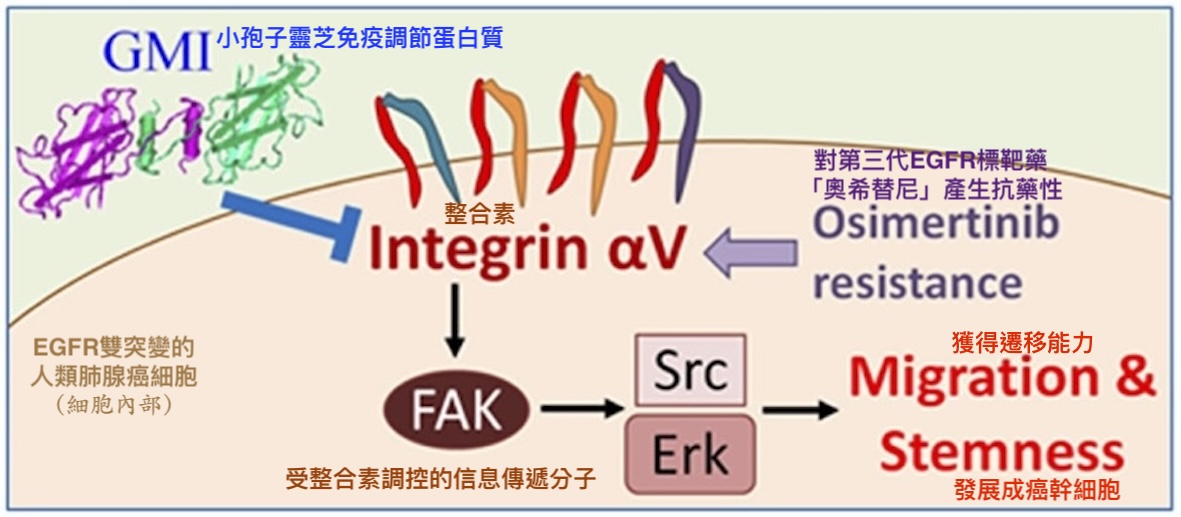
【图10】GMI抗癌机制示意图——以调控整合素αV为例
GMI可阻断整合素αV启动的讯息传递通路(Integrin/
FAK/Scr/Erk),抑制对奥希替尼有抗药性的EGFR
双突变人类肺腺癌细胞获得迁移能力与干细胞特性。
清除过量的整合素与EGFR
GMI让癌细胞从失控回到可控
本研究揭示GMI可以经由调控整合素来抑制EGFR双突变人类肺腺癌细胞的全新作用,跟阳明交通大学林东毅教授团队2023年发表的研究成果颇有异曲同工之妙。该研究在小鼠肺腺癌细胞LLC-1(对第一代EGFR标靶药有抗药性)的动物实验即观察到,以腹腔注射方式进入体内的GMI不只抑制肿瘤生长,也能大幅减少肿瘤组织里多种有利癌转移的整合素(详见相关报导:GMI抗肺腺癌转移的分子机制新发现:让癌细胞绑手绑脚,使其跑不了和尚也建不了庙)。
此外,本研究观察到GMI可以让突变型EGFR从人类肺腺癌细胞上消失的作用,也与阳明交通大学林东毅教授团队2023年发表的研究成果一致,其个中原理在林的论文亦有详细阐述(详见相关报导:GMI抑制EGFR阳性肺腺癌肿瘤的重要机制——迫使癌细胞吞掉自己的EGFR)。
如前所述,EGFR和整合素都是正常细胞会有的基本配备,差别在正常细胞只在需要时才把它们拿出来适度使用,用完之後就被细胞资源回收再利用;而癌细胞则是毫无限度地将它们大量表现、拼命使用,用到连旁边的正常细胞也跟着「变坏」。从现有的研究结果看来,源自灵芝家族、结构浑然天成的GMI【图11】显然是让癌细胞自废武功,让它们从失控的变态回归到可控的常态。当失序的细胞少了,健康新秩序的重建应该也就不远了。

【图10】小孢子灵芝免疫调节蛋白GMI的化学结构
由111个胺基酸组成的小孢子灵芝免疫调节蛋白GMI
是一个纯的蛋白质。图为GMI在蛋白质资料库PDB
登录的立体结构,代号3KCW。
〔资料来源〕Yu-Ting Kang, et al. Integrin αV Inhibition by GMI, a Ganoderma Microsporum Immunomodulatory Protein, Abolish Stemness and Migration in EGFR-Mutated Lung Cancer Cells Resistant to Osimertinib. Environ Toxicol. 2024 Dec;39(12):5238-5249. doi: 10.1002/tox.24399.
〔附图文献〕Cruz da Silva E, et al. Role of Integrins in Resistance to Therapies Targeting Growth Factor Receptors in Cancer. Cancers. 2019; 11(5):692.


