2018年7月,中山医学大学医学研究所柯俊良教授的团队在《Enviromnental Toxicology》发表了一篇报告证实,对於EGFR阳性的人类肺腺癌细胞,不管其EGFR是正常型或突变型,小孢子灵芝免疫调节蛋白质GMI都可通过抑制β-catenin表现量的方式,降低癌细胞的抗凋亡活性,把癌细胞推向穷途末路。这次的新发现,更加证明GMI这个由胺基酸组成的活性小分子蛋白,可以「多管齐下」制伏诡谲多变的肺腺癌。
文/吴亭瑶

属於非小细胞肺癌的肺腺癌约占所有肺癌患者的五成五,可说是对人类最具威胁的癌症。过去研究已证实,GMI既可抑制表皮生长因子EGF过度分泌所导致的人类肺腺癌细胞转移,也能诱导人类肺腺癌细胞自噬而亡;与顺铂并用时,还可加强顺铂造成的肺腺癌细胞凋亡;甚至能透过降低EGFR表现量,抑制EGFR突变的人类肺腺癌细胞。
因此这次的新发现,无疑是锦上添花,更加证明GMI这个由胺基酸组成的活性小分子蛋白,可以「多管齐下」制伏诡谲多变的肺腺癌。
让癌细胞生长失控的EGFR和β-catenin
同样是肺腺癌,恶性度却大不相同,其中癌细胞表面上的「表皮生长因子受体EGFR」是否过度表现(呈现阳性),即是常见的关键差异之一。
当EGFR的数量愈多,癌细胞的增生存活能力就愈强。这是因为EGFR会受到生长因子(如EGF)刺激,活化细胞内的酪胺酸激酶(tyrosine kinase, TK),进而启动细胞内一系列调控细胞生长的蛋白分子,促使癌细胞增生和转移。
上述所说还是正常型(wild-type)的EGFR,一旦EGFR发生突变(mutated),那麽不需外来刺激,其本身就会自动自发、持续不断地活化酪胺酸激酶,使癌细胞长得更快、更多,也更难以控制。
大家熟悉的肺癌标靶药艾瑞莎(学名Gefitinib)和得舒缓(学名Erlotinib),正是透过标靶和EGFR联动的酪胺酸激酶,把刺激癌细胞生长的讯息就此阻断,进而抑制癌细胞生长。只是EGFR很容易发生突变,一旦突变,原有的标靶药便无法发挥标靶作用而失去疗效。
至於位处细胞内的β-catenin(β-链蛋白)异常表现,则被认为和肺癌的形成息息相关。正常情况下,游离在细胞质中的β-catenin数量很少,然而包括肺癌在内的多种癌细胞都被发现,细胞质与细胞核内都有β-catenin的异常堆积。
由於β-catenin会进一步调控和癌细胞存活、增生有关的基因──例如启动具有抑制细胞凋亡的「抗凋亡基因」Survivin,以及促进cyclin -D1(细胞周期素D1)基因转录,加速癌细胞的增生等等──因此β-catenin的表现量,和癌细胞的存活与增生能力,密切相关。
先前已有研究发现,EGFR突变会提高β-catenin的表现量与活性,而当β-catenin受到抑制时,则会抑制EGFR突变的癌细胞生长。这意味β-catenin对於EGFR突变的肺癌会有如何进展,具有关键性的作用。
GMI降低β-catenin、Survivin和cyclin-D1的蛋白表现量
(1) 以GMI处理EGFR突变的肺腺癌细胞
根据柯俊良团队的研究显示,不论是带有突变型EGFR受体,且对酪胺酸酶抑制剂有高度敏感性的人类肺腺癌细胞株HCC827,或是带有双重突变EGFR,但对酪胺酸酶抑制剂(TKI)有抗药性的人类肺腺癌细胞株H1975,两者在与GMI(剂量0.6或1.2μM)一起培养48小时後,β-catenin蛋白表现量均显着减少,其下游的Survivin和cyclin-D1表现量也明显降低(如图1),并且能进一步促使癌细胞凋亡。
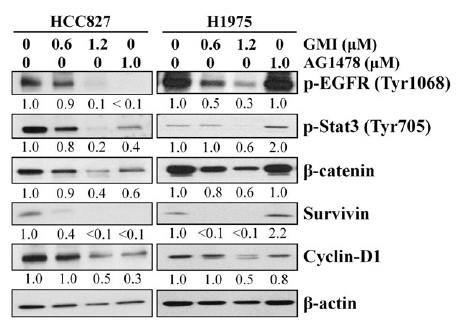
图1 GMI对於EGFR突变的肺腺癌细胞
其β-catenin相关分子表现量的影响
〔说明〕AG1478为酪胺酸激酶抑制剂;p-EGFR(Tyr1068)代表被EGFR活化的酪胺酸激酶;p-Stat3(Tyr705)为酪胺酸激酶的下游蛋白分子。β-actin则是存在於正常肌肉细胞的肌动蛋白,在此实验里作为对照组。从实验结果可以看出,GMI对於正常的肌动蛋白并无影响,但对於有助癌细胞增生和存活的酪胺酸激酶、Stat3、β-catenin、Survivin和cyclin -D1的蛋白表现量,都有显着的抑制作用。
(2) 以GMI处理带有正常型EGFR的肺腺癌细胞
同样的,对於带有正常型EGFR受体、但来源不同的三种人类肺腺癌细胞株H1355、H1299和A549,GMI也能在48小时的处理後,使β-catenin和Survivin的蛋白表现量明显减少(图2),并能进一步启动细胞凋亡(对H1355、H1299)或细胞自噬机制(对A549、H1355、H1299),把癌细胞推向死亡深谷。
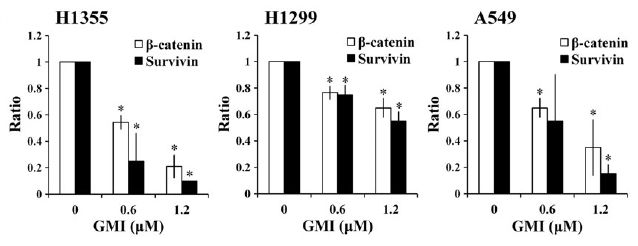
图2 GMI对於带有正常型EGFR肺腺癌细胞
其β-catenin和抗凋亡基因Survivin表现量的影响
GMI活化凋亡蛋白酶caspase-7,细胞凋亡不复返
不管是正常细胞或癌细胞,其凋亡效应主要是由细胞内一系列的凋亡蛋白酶(caspase)负责启动和执行,而caspase-7的活化,即与细胞凋亡的最终执行有关──表示细胞再也无法走回头路,只能一步步把凋亡的步骤走完,死而後已。
根据柯俊良团队的研究发现,经过GMI处理的几个肺腺癌细胞,不管是带有正常型EGFR的人类肺腺癌细胞株H1355和H1299,还是带有突变型EGFR的人类肺腺癌细胞株HCC827,对於caspase-7都有不等程度的活化作用(图3)。显示GM确实能诱导肺腺癌细胞凋亡。
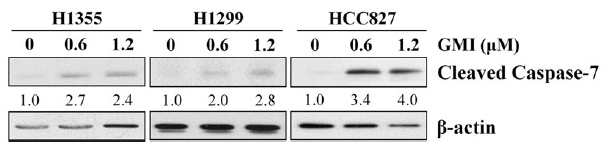
图3 GMI对於EGFR阳性的肺腺癌细胞
凋亡蛋白酶caspase-7的影响
GMI让β-catenin基因沉默,无法合成β-catenin蛋白
综合上述实验结果可知,GMI可以透过β-catenin蛋白表现量的抑制作用,限制EGFR阳性的肺腺癌细胞的增生与存活,进而减缓病情恶化的速度,甚或让病情获得缓解。
只是,GMI是如何让β-catenin的蛋白表现量降低呢?柯俊良团队的研究发现,GMI并无法抑制β-catenin的基因表现。也就是在GMI的影响下,上述那些肺癌细胞的β-catenin基因表现还是一样强劲。不过GMI却能让β-catenin基因「沉默」,无法进一步合成β-catenin蛋白;没有蛋白,就无法发挥功能,β-catenin基因的表现也就不具威胁性了。
〔资料来源〕Hsin IL, et al. GMI, a fungal immunomodulatory protein from Ganoderma microsporum, induce apoptosis via β-catenin suppression in lung cancer cells. Environ Toxicol. 2018 Jul 4. doi: 10.1002/tox.22582.


