2023年11月,卫福部国民健康署根据前一年的癌症登记报告公布,肺癌首度超越大肠癌,成为国人最容易发生的癌症。这个新头衔,加上蝉联19年国人癌症死因第一的旧头衔,使肺癌对你我的威胁性又上升一级。同年12月,阳明交通大学传统医药研究所林东毅副教授领衔发表在《Life Sciences》的「小孢子灵芝免疫调节蛋白GMI」抗肺腺癌转移研究成果,则是透过动物、细胞与分子机制详细说明,GMI干扰下的肺腺癌细胞是如何绑手绑脚地「跑不了和尚也不了庙」,为降低肺癌威胁性提供了锦囊妙方。
文/吴亭瑶

(https://www.sciencedirect.com/science/article/abs/pii/S0024320523008901?via%3Dihub)
癌转移的每个步骤都很关键
转移对於组织器官功能的破坏,是影响肺癌患者生活品质和生命长度的主因。由於肺癌的早期症状不易察觉,五到六成患者初次被诊断出来时多半已经晚期,使得肺癌患者承担的转移风险明显高於其他癌症患者。
所谓「转移」是指癌细胞从原发部位,经血液或淋巴循环,扩散到身体其他部位生长的过程。以经由血液循环转移为例:癌细胞必须转变成容易爬行且具侵袭性的细胞表型,才有办法脱离原始肿瘤,穿越细胞外基质,来到血管周围,钻过(渗入)血管进入血液循环,成为所谓的「循环肿瘤细胞」。
取得入场门票之後,癌细胞还需一边躲避白血球,一边寻觅新生地,等到天时地利人和再黏附到血管壁上,钻出(渗出)血管,穿越细胞外基质,然後才有机会落脚新的组织器官,另起炉灶落地生根【图1】。
由於癌细胞需要历经很多步骤才能转移成功,所以每个步骤都可以成为药物抑制癌转移的靶点。单独标靶其中一个步骤,很难做到全面拦截;如果可以同时干扰好几个关键步骤,层层卡关,就能把漏网之鱼减至最少。本研究观察到的GMI抗肺腺癌转移作用,恰好就属於後者。
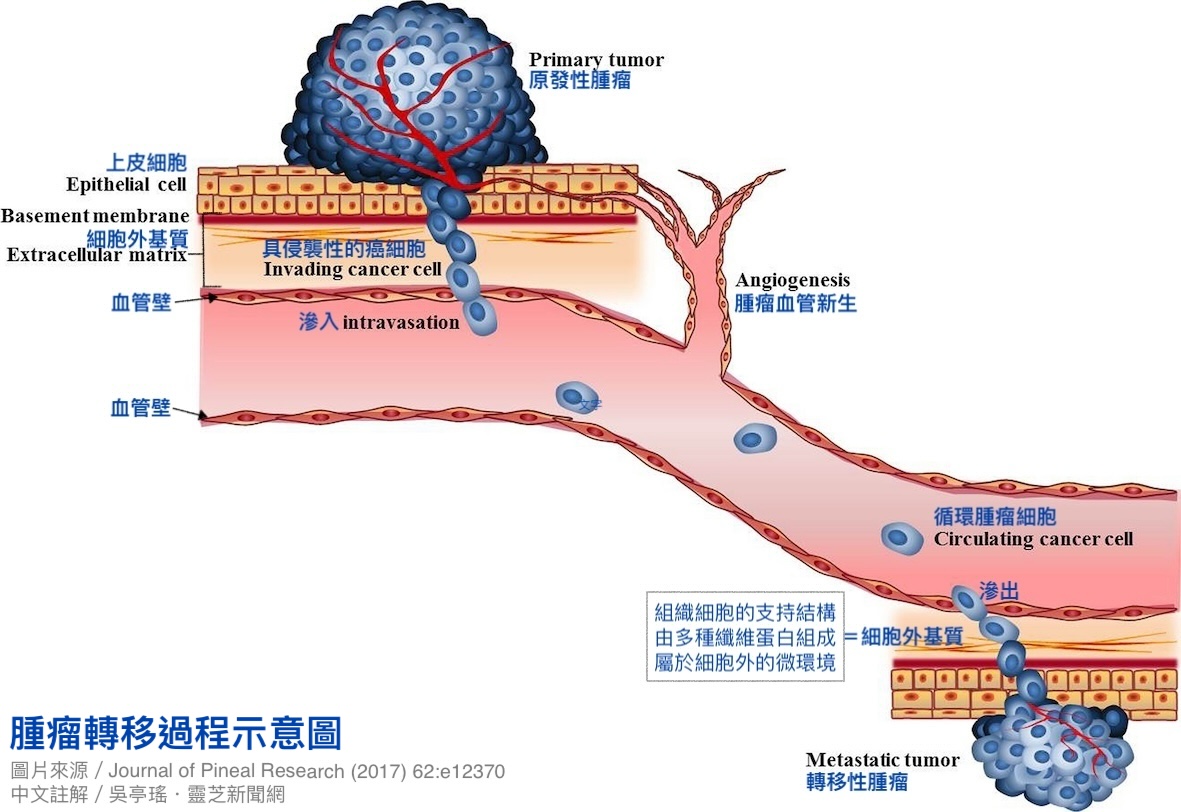
【图1】肿瘤转移过程示意图。
(https://onlinelibrary.wiley.com/doi/10.1111/jpi.12370)
GMI怎麽「卡关」肺腺癌转移?
① GMI可以半路拦截,阻止血液循环里的癌细胞落地生根
根据本研究的动物实验,同样是免疫功能正常的小鼠,同样从尾部静脉植入肺腺癌细胞LLC-1(EGFR阳性),後续有以GMI治疗者——每四天腹腔注射一次,每次剂量10 mg/kg——肺脏和肝脏长出肿瘤的机会明显低於未做治疗的控制组【图2】;即使长出肿瘤,肿瘤数量也明显较少,分布范围也明显较小【图3】。
注射到腹腔的GMI会经由腹膜微血管吸收进入血液循环,因此GMI组的肿瘤较小、较少,很可能是GMI干扰了血液循环中的肺腺癌细胞,使癌细胞穿越血管壁进到组织器官定居的能力大幅下降所致。这个保护作用大大削弱了肺腺癌的生命威胁——相对於控制组在癌细胞进入血液循环第31天就有小鼠死亡,不到35天就全军覆没,GMI组则是直到第50天仍有近七成的小鼠存活【图3】。
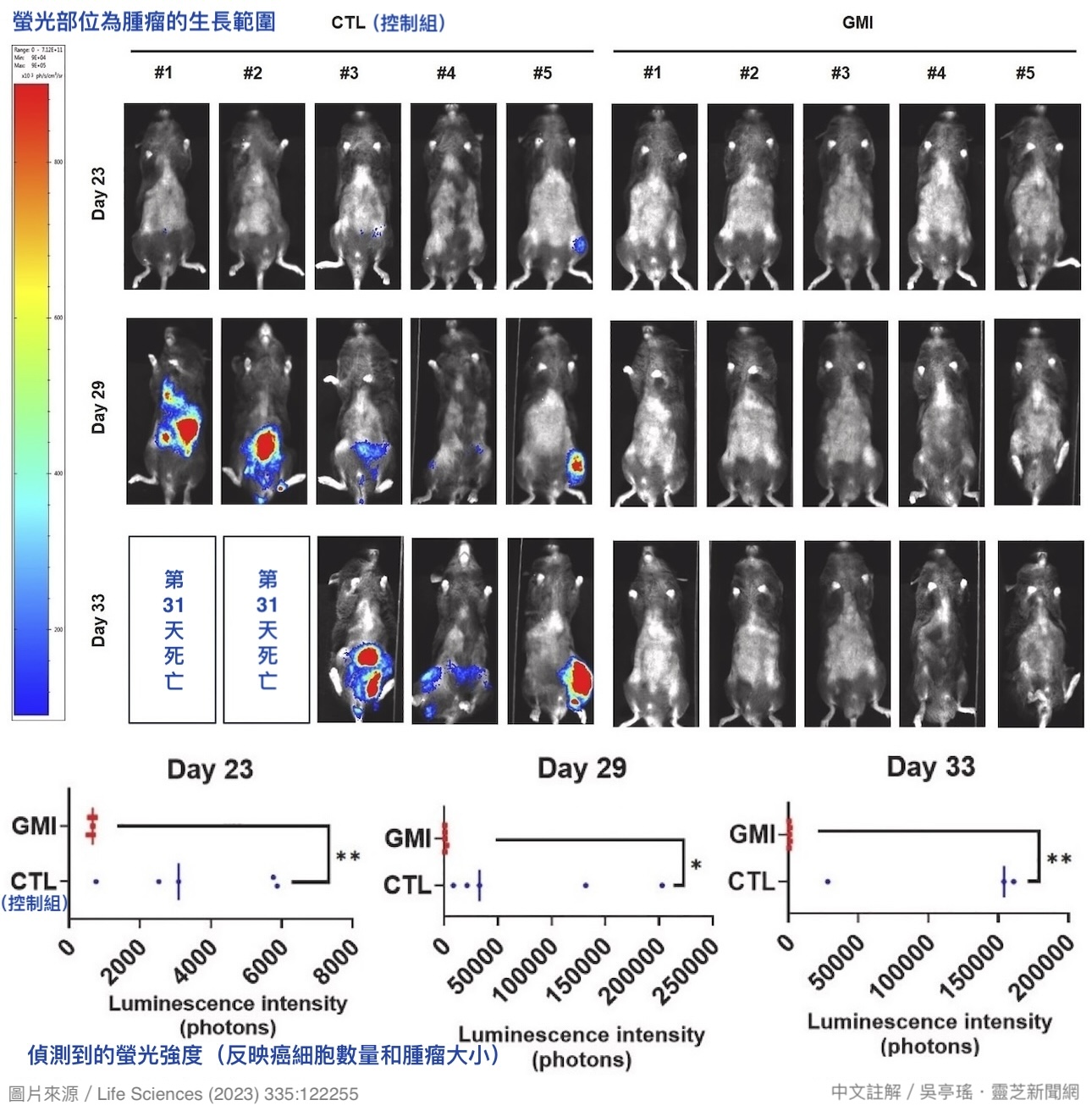
【图2】以活体冷萤光影像系统(IVIS)侦测肺腺癌细胞从血液循环进到小鼠器官长出肿瘤的情形。结果显示,GMI组的肿瘤生成率与生长速度远远低於控制组。
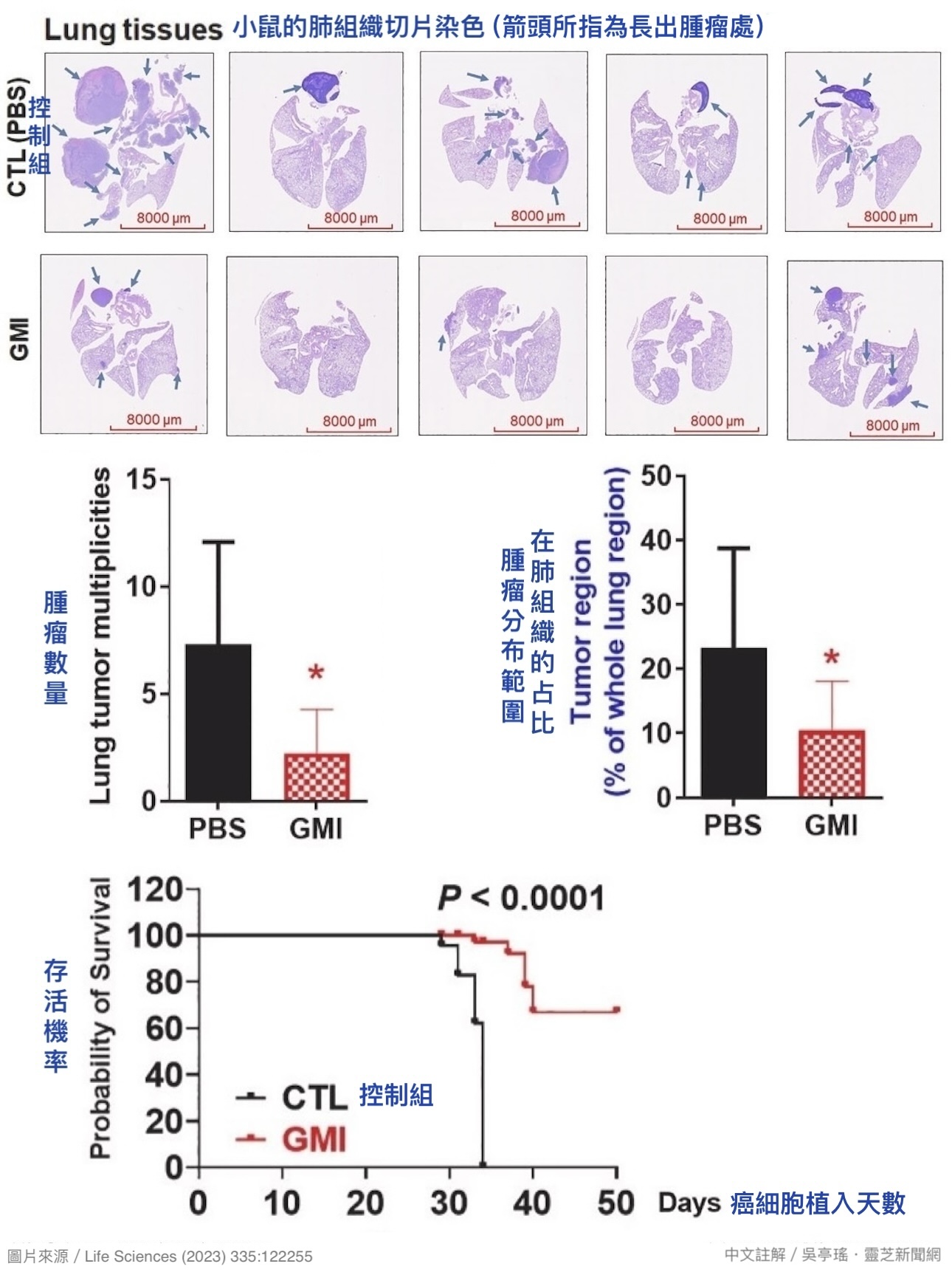
【图3】小鼠尾部静脉植入肺腺癌细胞第28天肺部长出肿瘤的情形,以及小鼠尾部静脉植入肺腺癌细胞之後在不同时间节点的存活率。结果显示,GMI组不只肿瘤数量少,受到肿瘤侵犯的组织面积比较小,存活期较长,存活率也比较高。
② GMI也可先下手为强,防止癌细胞脱离原始肿瘤向外侵袭
上述实验结果说明GMI可以在下游拦截血液循环里的癌细胞,让它们功败垂成;本研究的另一个动物实验则观察到,GMI还能在上游「绑住」蠢蠢欲动的肺腺癌细胞,力阻癌转移的发生。
肿瘤里的癌细胞连结得很紧密的,当癌转移的开关被启动後,癌细胞的表现型态会从排列紧密、不易移动的「上皮型」,逐渐转变成排列松散(容易松脱)、有利迁移(爬行)的「间质型」,藉由这个简称EMT的「上皮-间质转化」(epithelial-mesenchymal transition)过程,逐渐增强癌细胞侵犯周边组织的能力【图4】。

【图4】癌细胞从「上皮型」转化成「间质型」,进而脱离原始肿瘤、储备迁移力和侵袭性的过程。(https://doi.org/10.1186/s12964-021-00713-2)
癌细胞从稳定性高的「上皮型」转化成侵略性强的「间质型」的过程中(以下将此过程简称EMT),细胞表面有助癌转移的整合素(integrin)会显着增加,细胞内部相关的蛋白分子表现也会有所改变,包括:
❖ 驱动EMT发生的转录因子(如Slug)会被活化和增加;
❖ 连结细胞与细胞之间的黏附分子也从全部都是黏性高的E-钙黏蛋白(E-cadherin),开始出现黏性低的N-钙黏蛋白(N-cadherin)掺杂并存;
❖ 细胞骨架中有助细胞维持硬度与弹性的波形蛋白(vimentin)也会变多。
上述这些变化都可用来评估癌转移的动能高低。在本研究的动物实验里,当肺腺癌细胞(LLC-1)被植入皮下之後,每四天腹腔注射一次GMI(10 mg/kg)的小鼠,不只长出来的肿瘤明显小於控制组(意谓发生癌转移的本钱比较少),肿瘤组织里和癌转移相关的指标也明显较少【图5】。这说明GMI有「绑住」癌细胞的作用,使肺腺癌细胞比较不易取得转移的能力。
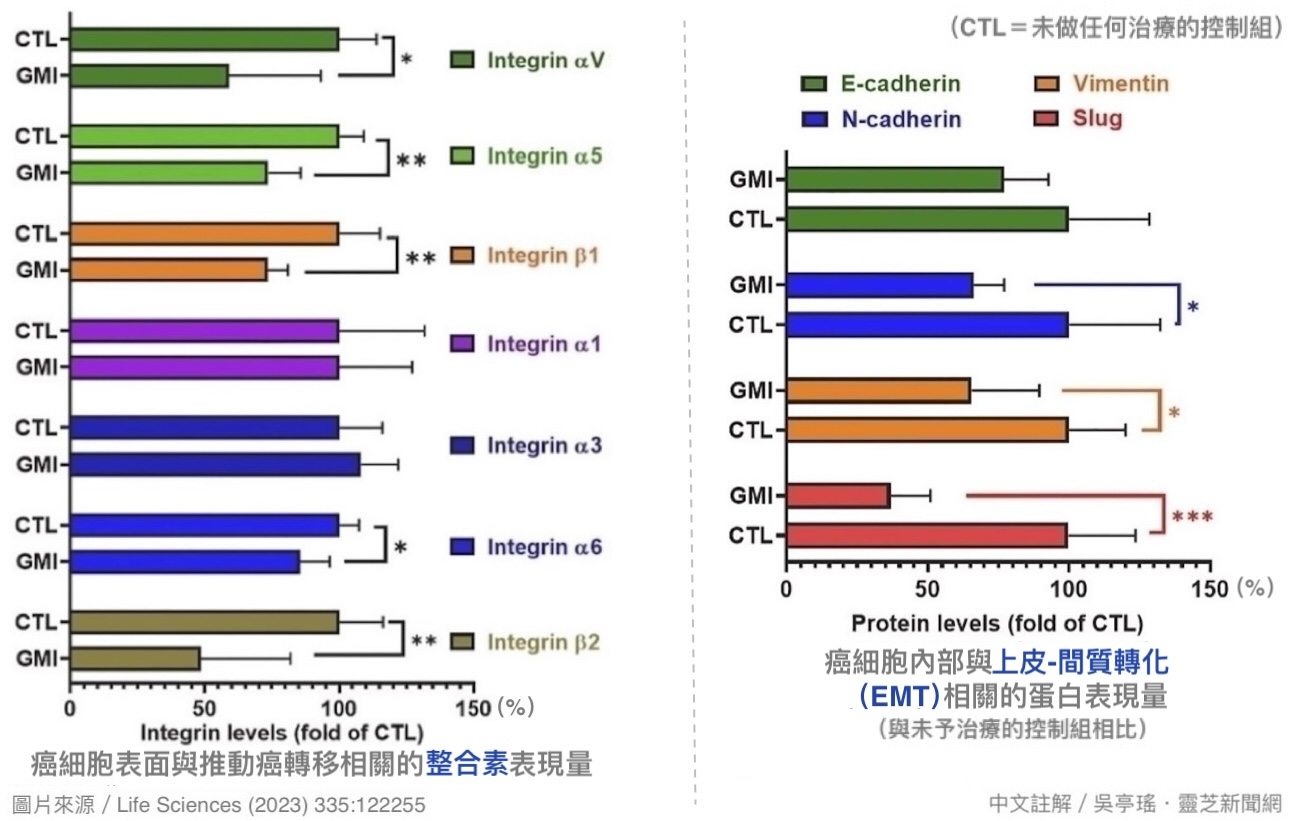
【图5】小鼠皮下植入肺腺癌细胞3~4周後,肿瘤组织中有助推动癌转移发生和进行的整合素,以及反映癌细胞转型成有利脱离原始肿瘤向外侵袭的EMT指标。结果显示,GMI组的癌转移动能明显低於未做任何治疗的控制组(CTL)。
③ GMI还能从中作梗:削弱癌细胞的黏附力(抓地力)和迁移力
本研究还通过体外实验证明GMI能够抑制多种「人类肺腺癌细胞」的迁移能力:不管是恶性度一般的A549,还是具有高度转移性的CL1-5,抑或EGFR双重突变且对艾瑞莎有抗药性的H1975,当它们与GMI(0.3 μM)一起培养24小时之後,癌细胞的迁移能力都会大幅下降【图6】。
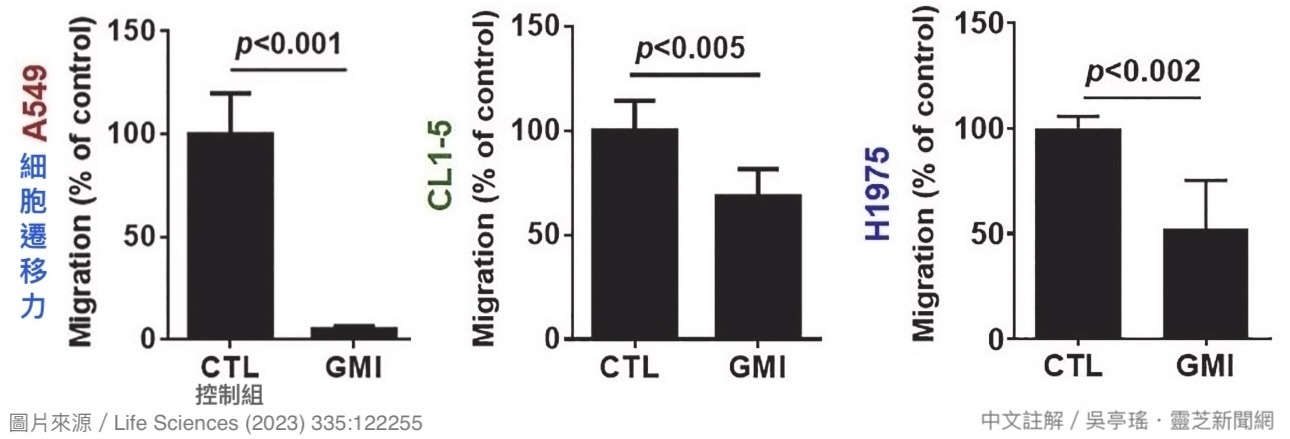
【图6】三种不同恶性度的人类肺腺癌细胞经GMI(0.3 μM)处理24小时仍具迁移能力的癌细胞数。结果显示,癌细胞的迁移能力会因GMI的干扰而大幅降低。
癌细胞的迁移能力是癌转移能否成功的重要关键,因为不论是癌细胞从原乡出发「披荆斩棘」前往血管或淋巴管周边,还是从血液循环上岸「披荆斩棘」前往新生地,都必须依靠「迁移能力」穿越细胞外基质才能抵达目的地。不过癌细胞并不是想动就能动,而是需要把它的脚(伪足)「黏附」在细胞外基质上,才能一步步地往前推进【图7】。
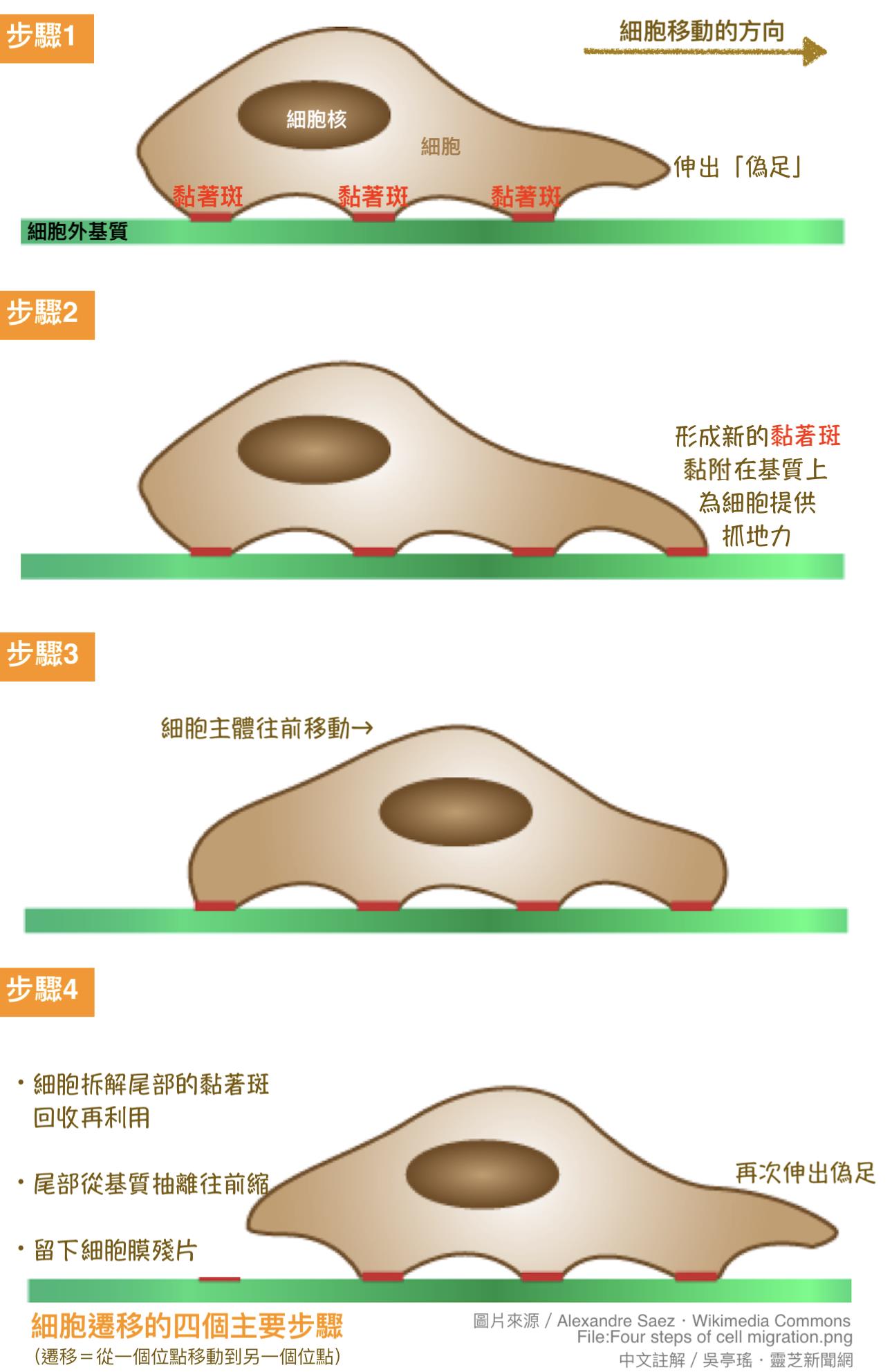
【图7】细胞迁移的步骤。
(https://commons.wikimedia.org/wiki/File:Four_steps_of_cell_migration.png#)
换句话说,细胞迁移并不是唏呖呼噜地连滚带爬,也不是心想事成的瞬间位移,而是要踩稳这一步才有下一步的稳步爬行。因此有如抓地力的「黏附力」就成了癌细胞能否穿越细胞外基质关键,如果每次伸出脚都要搞半天才踩得稳,自然会拖慢细胞迁移的速度。此外,进到血液循环的癌细胞也必须发展出有如定锚作用的「再黏附力」抓住血管壁,才有办法钻出血管继续未竟的转移之业。
由此可见黏附力对癌转移的非常重要。而根据本研究的体外实验显示,GMI(0.15~0.6 μM)能在2小时内对前述三种人类肺腺癌细胞的「黏附力」和「再黏附力」发挥显着的抑制作用,且效果与GMI浓度呈正相关【图8】,说明GMI之所以既能抑制肺腺癌细胞迁移【图6】,也能阻止血液中的癌细胞进到组织器官落地生根【图2、图3】,都与GMI降低癌细胞的黏附力密切相关。
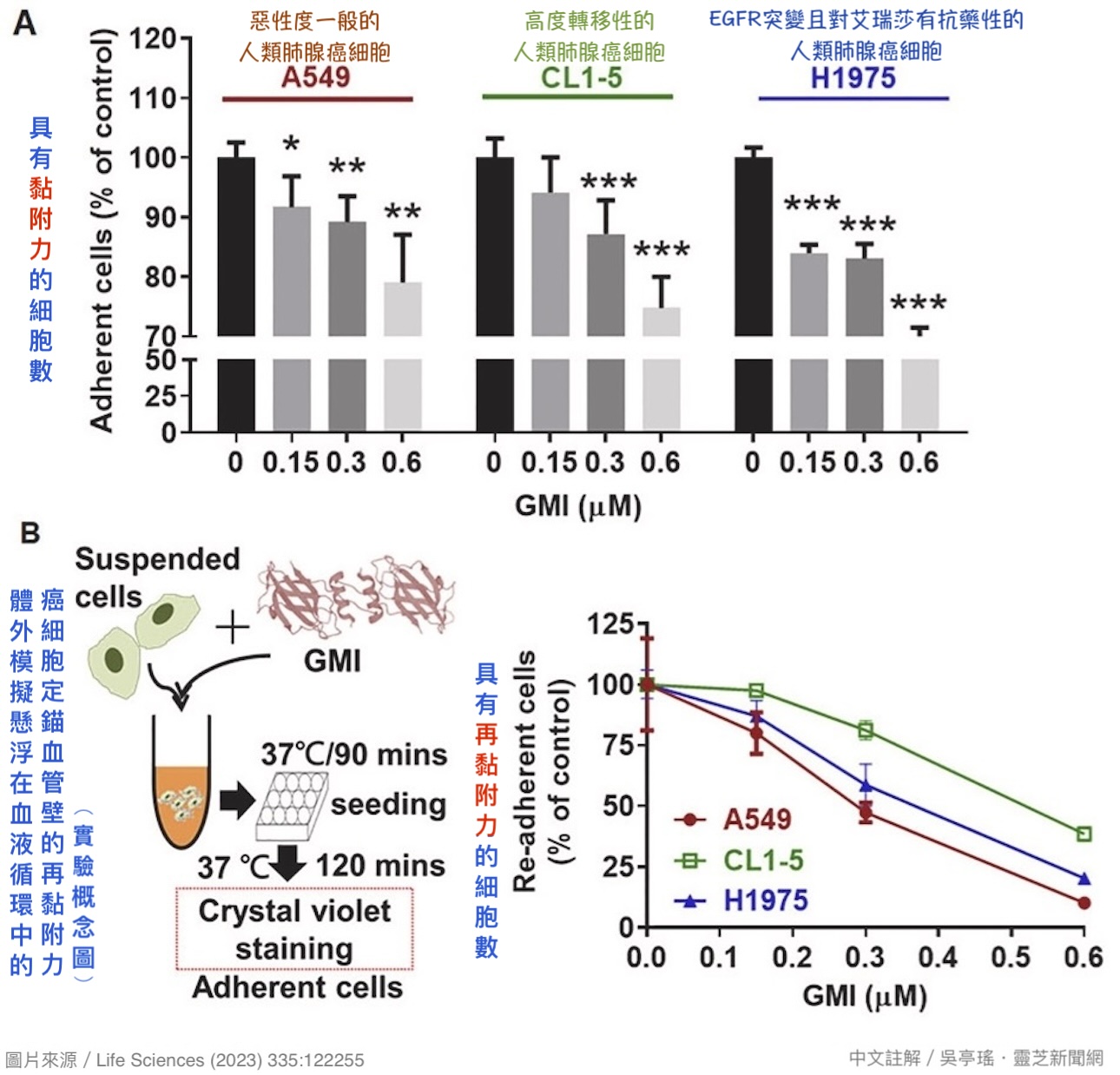
【图8】三种不同恶性度的人类肺腺癌细胞经不同浓度的GMI处理2小时仍具黏附能力的细胞数。结果显示,GMI可大幅降低癌细胞的黏附力与再黏附力。
GMI怎麽「绑住」肺腺癌细胞?
① GMI能结合癌细胞表面,由外而内直接调控
本研究的另一个实验发现,GMI(0.3 μM)在加入人类肺腺癌细胞10分钟之後即会结合在癌细胞表面【图9】,这似乎暗示GMI可以「由外而内」直接调控癌细胞的行为模式,让它们想坏却坏不太起来。
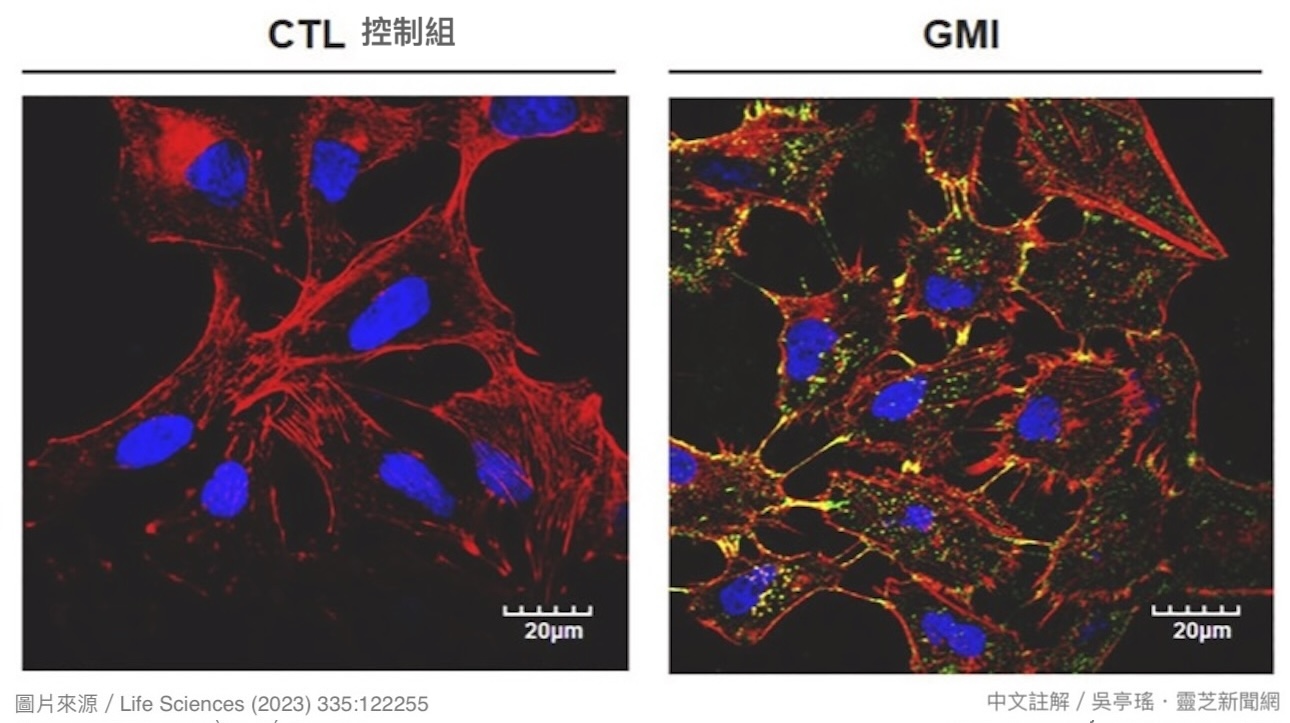
【图9】绿色萤光为GMI,蓝色为人类肺腺癌细胞A549的细胞核,红色为细胞骨架结构中的纤维肌动蛋白(F-actin)——它们会聚集在细胞前进方向的最前端,把细胞膜向外推,形成突出的丝状伪足(filopodia),拉动细胞往前移。相较於只有癌细胞的控制组(左图),经GMI(0.3 μM)处理10分钟的癌细胞表面结合了许多GMI,尤其是在丝状伪足的位置(右图)。
② GMI能下调千百种「膜蛋白」的表现量,阻挡外部诱因对於癌转移的推进
细胞表面各式各样的膜蛋白(细胞膜上的蛋白质)是细胞接收细胞外讯息的窗口,其表现量之高低,反映着它们对细胞行为的影响力。根据本研究对三种人类肺腺癌细胞共计5531种膜蛋白进行的分析显示:
恶性度一般的A549细胞在GMI(0.6 μM)处理24小时後,有1868种膜蛋白的表现量显着降低(减少25%以上);换成高度转移性的CL1-5细胞,或是EGFR双重突变且对艾瑞莎有抗药性的H1975细胞,则分别有944种和994种膜蛋白的表现量会因GMI的介入而显着降低【图10A】。
此结果说明GMI的确能「由外而内」调控肺腺癌细胞,而且调控的细节会视肺腺癌细胞的不同而有所差异,颇有因材施教的意味。不过异中有同的是,其中106种膜蛋白不管长在这三种癌细胞的哪一个,都会被GMI下调;而根据大数据分析,这106种膜蛋白同时下调最有可能的结果,就是抑制细胞迁移与癌转移,与细胞和动物实验的结果遥相呼应。
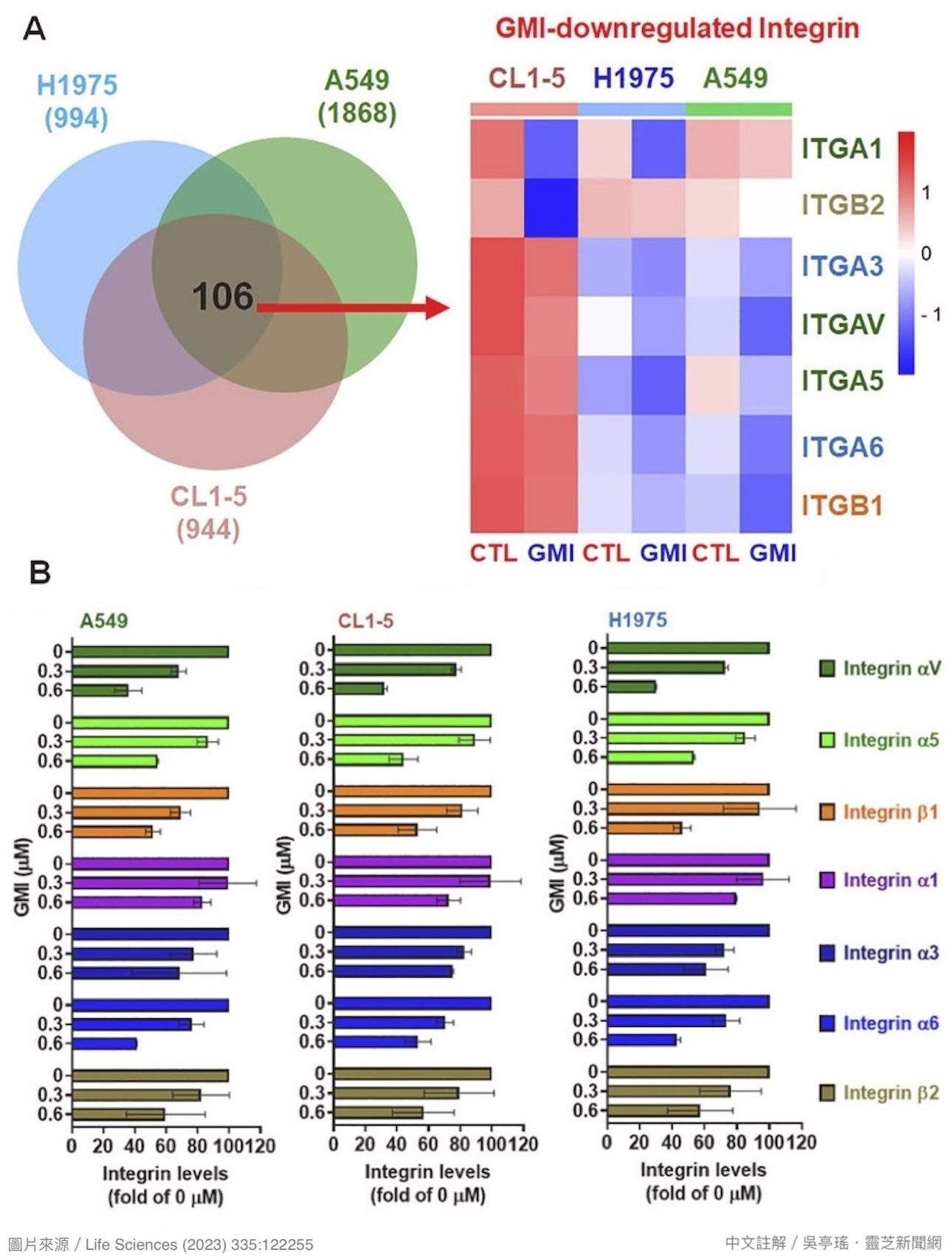
【图10】(A) 以GMI(0.6 μM)处理人类肺腺癌细胞,24小时後表现量下降25%以上的膜蛋白数量与整合素种类。 (B) 以GMI(0.3或0.6 μM)处理人类肺腺癌细胞,2小时後细胞表面的整合素β1、αV、α5和α6表现量明显下降,且有量效关系。
③ GMI能下调整合素表现量、阻止FAK活化、促进Slug降解,让癌细胞绑手绑脚
研究者进一步缩小范围,从这106种膜蛋白找出跟癌转移有关的「整合素」,并且配合细胞实验实际确认GMI的影响,结果发现共有四种整合素(β1、αV、α5和α6)的表现量可以在2小时内被GMI(0.6 μM)下调50%以上【图10B】。
这些整合素即是癌细胞可以黏附细胞外基质的主干。当它们因外来刺激活化後,对外会连结细胞外基质里的纤连蛋白,对内则会吸引大批蛋白质聚集在它的周围,形成可以与细胞骨架联动的黏着斑(focal adhesion),为细胞迁移提供必要的黏附力(抓地力)【图11】。
其中简称FAK的黏着斑激酶(focal adhesion kinase)是最早聚集到整合素周围的蛋白质之一。当FAK与整合素结合後,会接着活化一大串的下游分子(包括驱动EMT发生的转录因子Slug),加速癌细胞的增生和转移。
不过本研究却发现,GMI不只能降低相关整合素的表现量,还能减少FAK被活化的机会,并把Slug送进细胞的资源回收中心分解【图12】。前两者会抑制黏着斑的形成,使癌细胞因为黏附力不足而不易迁移;後者则会阻止癌细胞打开「上皮-间质转化」的开关,降低癌细胞脱离原始肿瘤向外侵袭的机会。两相作用下让肺腺癌细胞既绑手又绑脚,大大提高癌转移的门槛和难度。
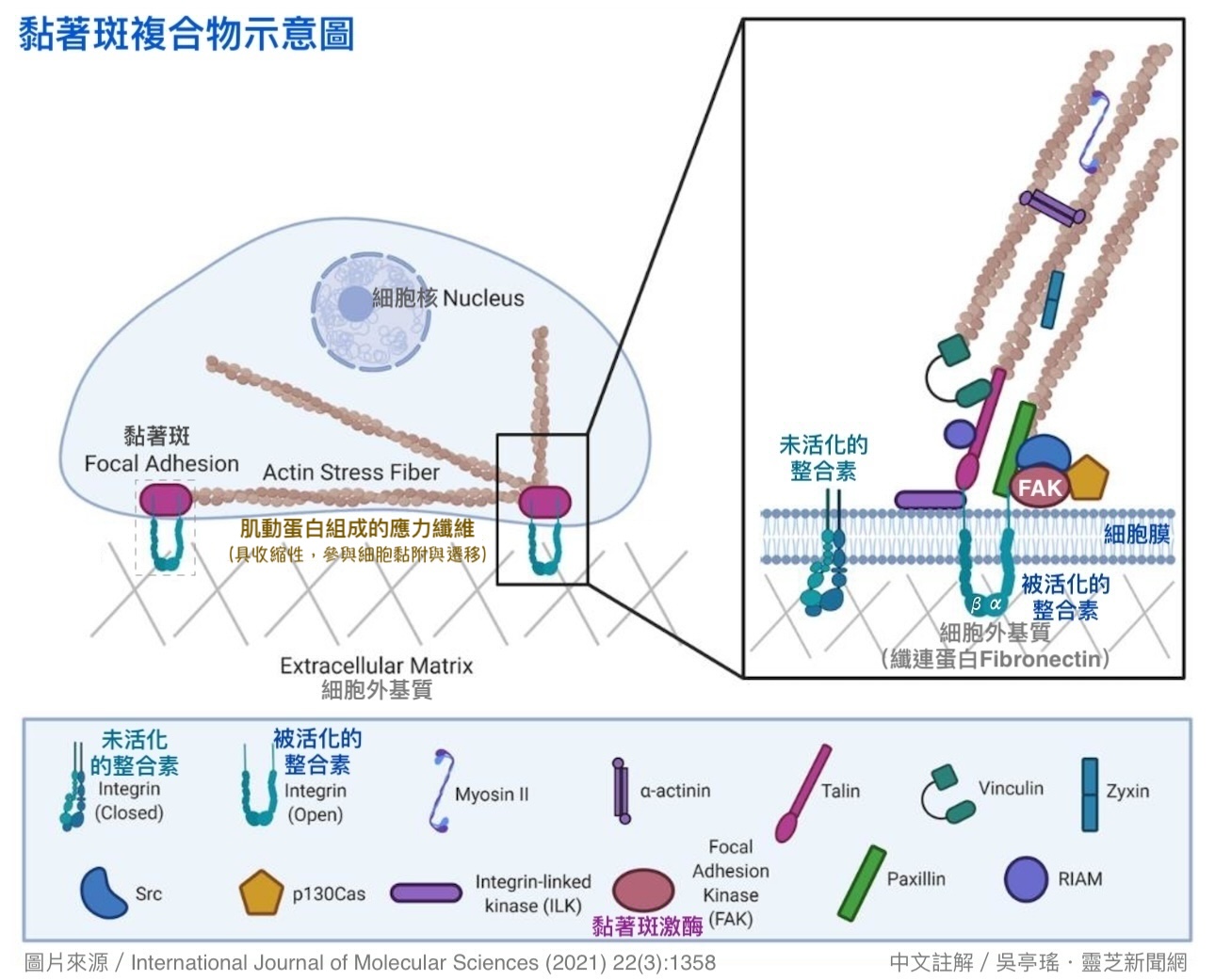
【图11】黏着斑复合物示意图。与细胞骨架(肌动蛋白应力纤维)联动的「黏着斑」是一个大型的蛋白复合物,由位於细胞膜上的整合素、细胞外基质的纤维蛋白,以及结合在整合素上的一百多种蛋白质(如:黏着斑激酶FAK)共同组成。由於FAK居关键位置,少了它将无法形成牢靠的黏着斑,癌细胞的迁移过程中就会备受阻碍。(https://www.mdpi.com/1422-0067/22/3/1358)
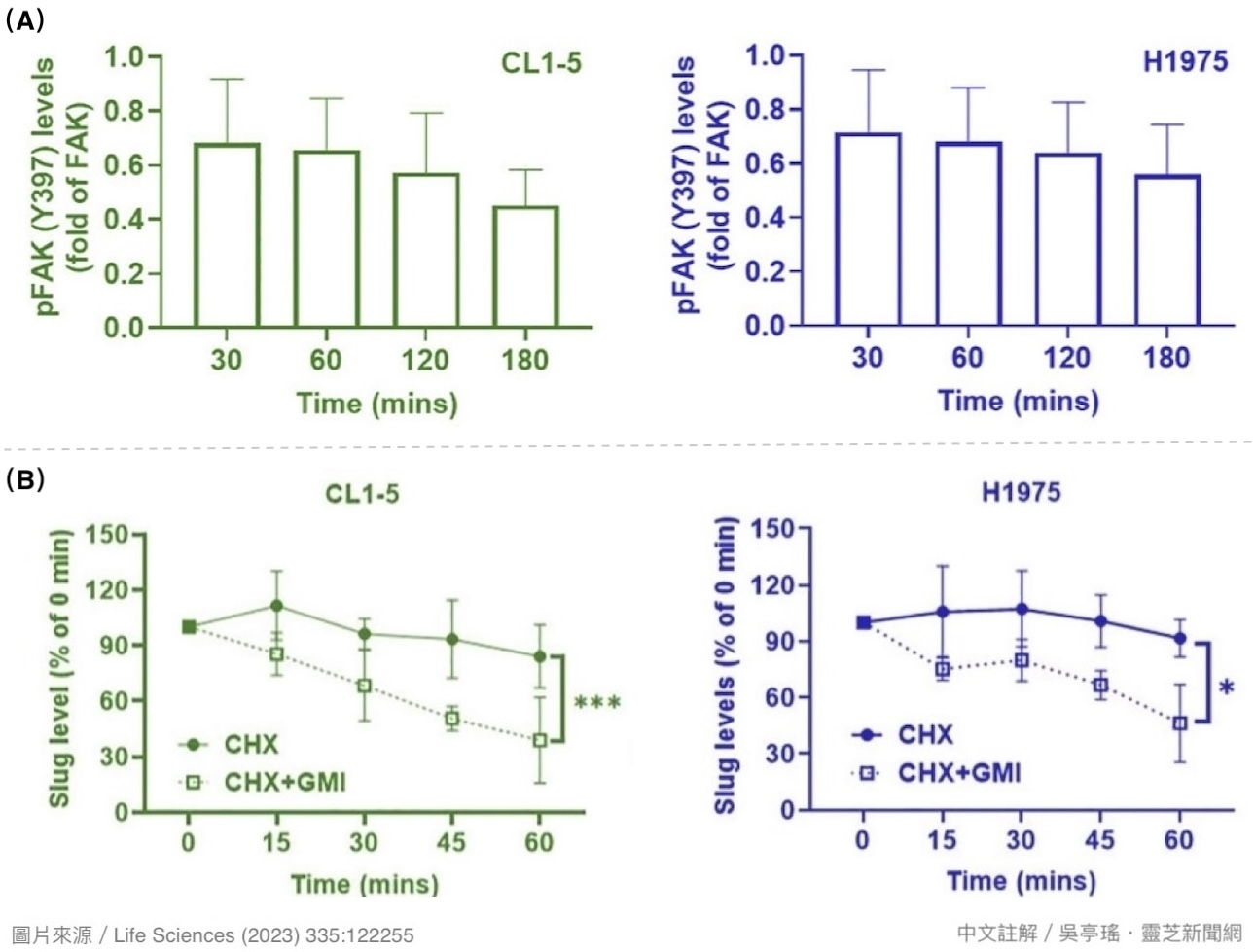
【图12】(A) 以GMI(0.6 μM)处理人类肺腺癌细胞,细胞内磷酸化(活化)的FAK数量会随时间下降。 (B) 以GMI(0.6 μM)处理人类肺腺癌细胞,细胞内的Slug水平随时间下降的程度(虚线)远超过没有GMI(实线)的组别。
单一成分多重标靶,GMI抗肺腺癌转移的潜力令人期待
不论是以整合素、FAK、Slug为靶点,还是力阻EMT的发生,都是抗癌新药开发的方向,而且只要做到其中一点,就会被视为极具潜力的新星。如今作为单一成分的GMI【图13】却能多点标靶【图14】,打破许多人对於一种成分只能标靶一个靶点的刻板印象,加上先前已被证实GMI可以标靶EGFR抑制肺腺癌肿瘤生长,无一不正中棘手肺癌的治疗需求,集如此多的功能於一身,不知该给GMI几颗星才算足够?
诚如本文先前所言,单独标靶其中一个步骤很难做到全面拦截,如果可以同时干扰好几个关键步骤,层层卡关,就能把漏网之鱼减至最少。科学证明GMI多点标靶的抗肺转移作用无疑提醒着我们,降低肺癌威胁的「新药」其实已经近在眼前。
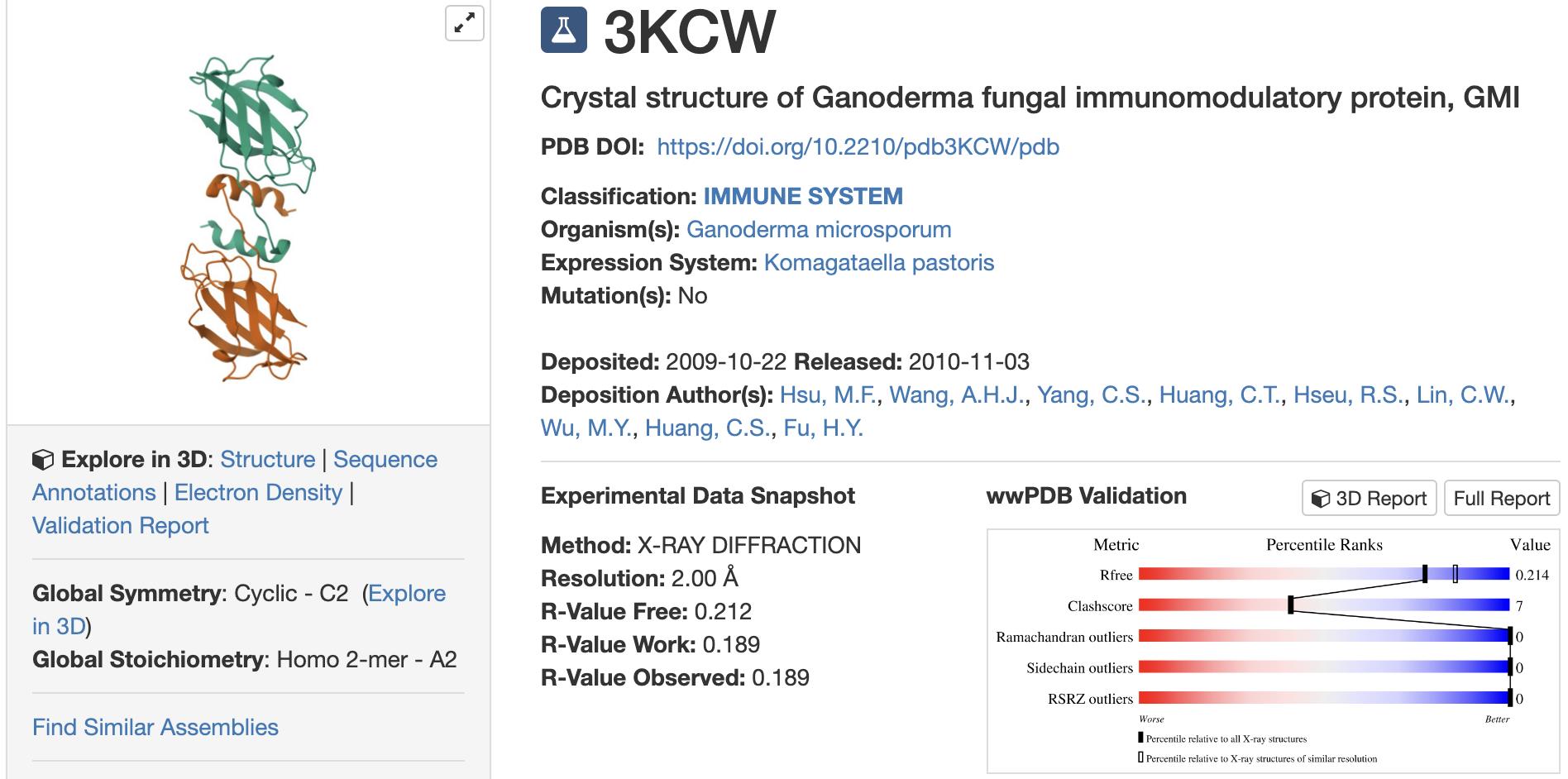
【图13】由111个胺基酸组成的小孢子灵芝免疫调节蛋白GMI(Ganoderma microsporum immunomodulatory protein)是一个纯的蛋白质。图为GMI在蛋白质资料库PDB(Protein Data Bank)登录的3D结构,代号3KCW。
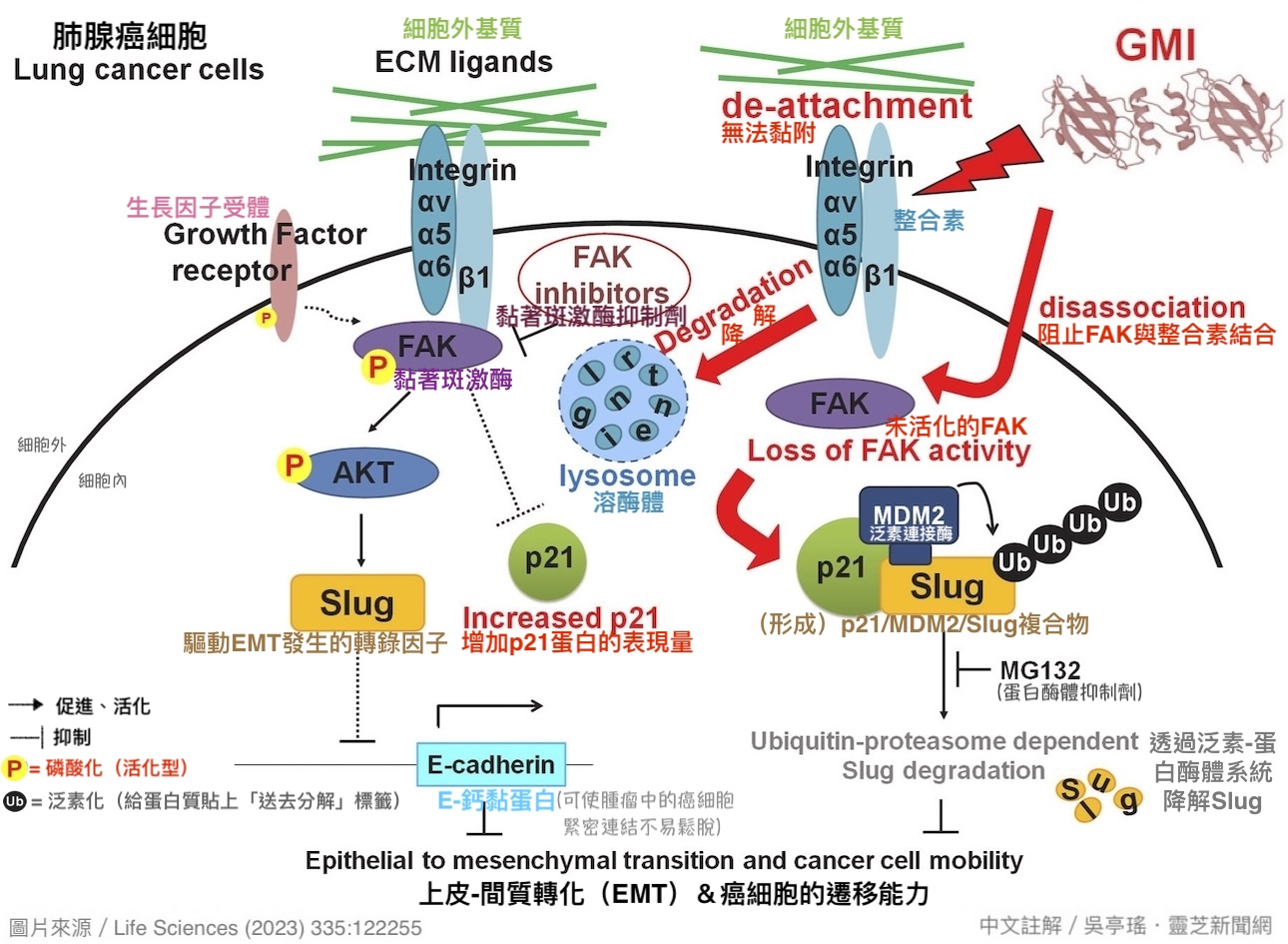
【图14】经本研究证明的GMI抑制肺腺癌细胞转移的细胞分子机制。
〔资料来源〕Hung-Chih Lo, et al. GMI, a Ganoderma microsporum protein, abolishes focal adhesion network to reduce cell migration and metastasis of lung cancer. Life Sciences, 2023 Dec 15:335:122255. doi: 10.1016/j.lfs.2023.122255.
〔其他参考文献〕
1. 健康远见编辑部。癌王换「肺癌」!10大癌症排名出炉,大肠癌15年来首居次位。健康远见官网,2023年11月10日发布。
2. 赖淑敏等。癌症连41年居10大死因榜首,新冠去年1.4万死排第3。公视新闻网,2023年6月12日发布。
3. 郭志熙医师。四成肺癌发现时已骨转移!? 积极治疗一棒接一棒抗癌。癌症希望基会网站,2023年7月6日发布。
4. 何明霖医师。肺癌转移到脑骨肝。台湾肺癌病友诊治卫教关怀网站,2020年8月1日发布。
5. Shih-Chi Su, et al. Cancer metastasis: Mechanisms of inhibition by melatonin. Review J Pineal Res. 2017 Jan;62(1). doi: 10.1111/jpi.12370.
6. Susan E Leggett, et al. The epithelial-mesenchymal transition and the cytoskeleton in bioengineered systems. Review Cell Commun Signal. 2021 Mar 10;19(1):32. doi: 10.1186/s12964-021-00713-2.
7. Samanthi Udayangani. Difference Between Cell Migration and Invasion. Difference Between.com. March 31, 2017 Posted.
8. Korinn N. Murphy, et al. Manipulation of Focal Adhesion Signaling by Pathogenic Microbes. Int J Mol Sci. 2021 Jan 29;22(3):1358. doi: 10.3390/ijms22031358.


