「细胞自噬」这个冷僻的专有名词,因为日本学者大隅良典荣获2016诺贝尔医学奖而变得家喻户晓。用如此高的殊荣来肯定他在基础科学上的贡献,不难想见了解细胞自噬这件事对於医学发展有多重要。巧合的是,灵芝免疫调节蛋白的抗癌机制,主要就是来自细胞自噬作用的调控,其发现者正是中山医学大学柯俊良教授所率领的研究团队。
文/吴亭瑶
★敬请尊重着作权,欢迎以连结网址的方式友善分享,请注明作者、出处与图片来源,并保留文章「从标题到参考文献」的完整性,请勿将图文移花接木、占为己有,或与商品、商业行为连结。
10月3日晚上七时许,当方念华主持的《Focus全球新闻》以最新消息发布,日本东京工业大学教授大隅良典,因研究「细胞自噬」荣获诺贝尔医学奖时,原本吃饱想睡的我瞬间清醒,脑袋第一个想到的是「灵芝蛋白」与「柯俊良」。因为这位中山医学大学医学研究所教授,正是灵芝学界第一个证明「灵芝可在肿瘤动物体内透过『细胞自噬』作用抗癌」的学者,其所使用的材料正是灵芝里特有的免疫调节蛋白(以下简称灵芝蛋白)。
联络上柯俊良时,电话那头的他也难掩喜悦。原来他在2011年发表的第一篇灵芝蛋白促使肺腺癌细胞自噬死亡的研究,就有用到新科诺贝尔医学奖得主提供的材料。虽然彼此间并不认识,仅用e-mail联系,大隅良典仍大方的无偿予以协助,显示其对细胞自噬相关研究有着一股纯粹的热情。一如中央社报导,大隅在获奖後回应媒体,当初他之所以埋首研究细胞自噬的机制,并不是因为它未来有什麽用,纯粹是「去发现没人做的事,其实是很快乐的。」
看到「细胞自噬」四个字,报导灵芝十多年的我,
马上想到柯俊良教授研究多年的灵芝蛋白。(摄影/吴亭瑶)

虽然他们彼此间并不认识,仅用e-mail联系,
但大隅良典仍大方的无偿提供材料让柯俊良做研究,
显示其对细胞自噬相关研究有着一股纯粹的热情。
(左图资料来源/维基百科,右图摄影/杨文卿)
为什麽「细胞自噬」这麽重要?
什麽是「细胞自噬」?那是细胞在肌饿状态下的自我保护机制,透过「自己吃自己」,吞噬细胞内比较不重要的细胞物质,再将它们进一步分解为养料(如:胺基酸或脂肪酸等小分子)重复利用来维系生命。如果能适时获得养分的补给,细胞就有机会存活下来;倘若一直等不到救援物资,细胞就会死亡。
早在1960年代就有人观察到细胞的自噬现象,但直到1990年代大隅良典的研究和阐明,科学界才知道细胞内哪些基因的改变会引发细胞自噬,以及细胞内部「从自噬发生,到细胞死亡或存活的整个过程」会出现哪些变化。
也因为他打下的基础,後面的科学家才会进一步发现,原来和癌症、自体免疫疾病(如类风湿性关节炎)、糖尿病、阿兹海默症等诸多疾病都与细胞自噬作用的失衡有关。如果能够调控细胞自噬作用的机制,许多难治之症便有治癒的可能。
大隅良典带来的医疗希望,正是诺贝尔医学奖表扬他的原因;而用如此高的殊荣来肯定他的贡献,不难想见「细胞自噬」这件事对於医学发展有多重要。
「灵芝蛋白GMI」单用或与化疗并用,都能加速肺癌细胞自噬死亡
如何针对不同疾病进行细胞自噬的调控,以达到治病效果,是近十年才开始热门的研究议题。很多科学家都在找方法,而走在浪潮前端的柯俊良授则已多次证明,灵芝蛋白正是调控癌细胞自噬作用的高手。
研究显示,给植入肺癌细胞的裸鼠(免疫系统缺陷小鼠)喂食小孢子灵芝蛋白GMI,每天只要160 μg(=0.16 mg)的微小剂量,即可有效抑制肿瘤生长(图1)。其肿瘤组织切片表现出显着的细胞自噬反应,说明GMI正是透过此机制发挥抑瘤作用【1、2】。
即使面对的是「具有抗药性」的肺癌细胞, GMI同样可以用160 μg的剂量在裸鼠体内发挥抑制肿瘤的作用,而且不管是在肿瘤还不明显时就给GMI(图2),或是等长出一定大小的肿瘤再给GMI(图3),效果都很显着,其主要的作用机制也和「加速癌细胞自噬死亡」有关【3】。
此外,细胞实验也证实,不管GMI与顺铂(cisplatin)联手对付一般的肺癌细胞,或与欧洲紫杉醇(docetaxel)联手对付具「对欧洲紫杉醇有抗药性」的肺癌细胞,都能通过细胞自噬作用,大幅提升癌细胞的死亡率(图4)【3、4】。
至於灵芝免疫调节蛋白到底调控了癌细胞内的哪些基因,活化了哪些蛋白分子,才让肺癌细胞进入自噬状态的,柯俊良的团队也做了详细的分析(图5)【1~4】。
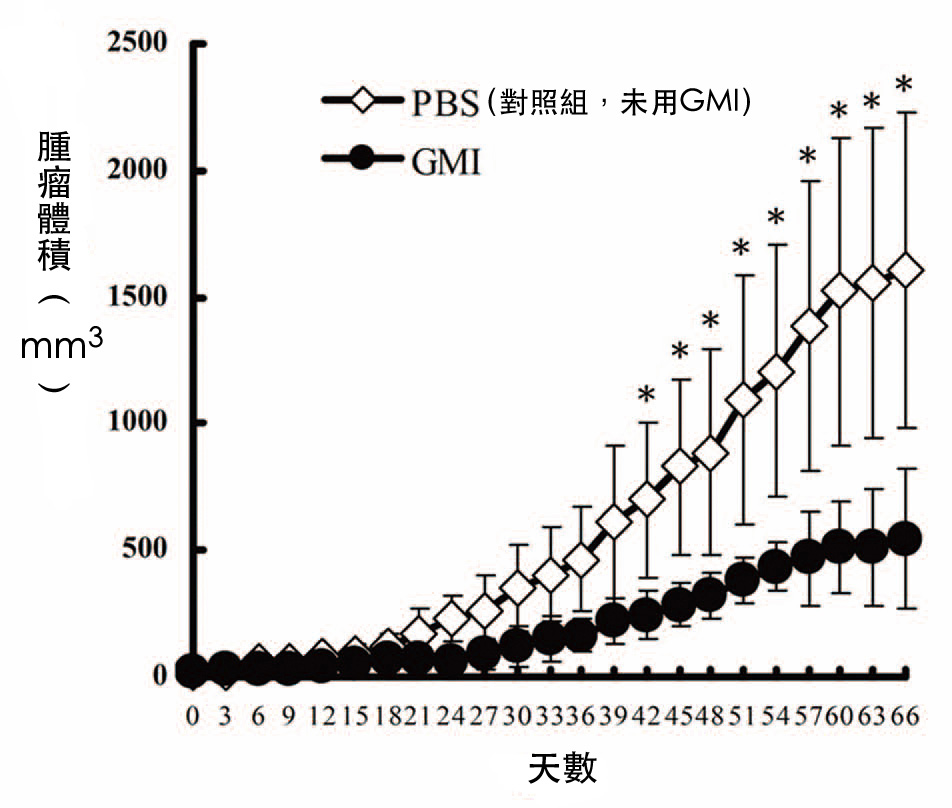
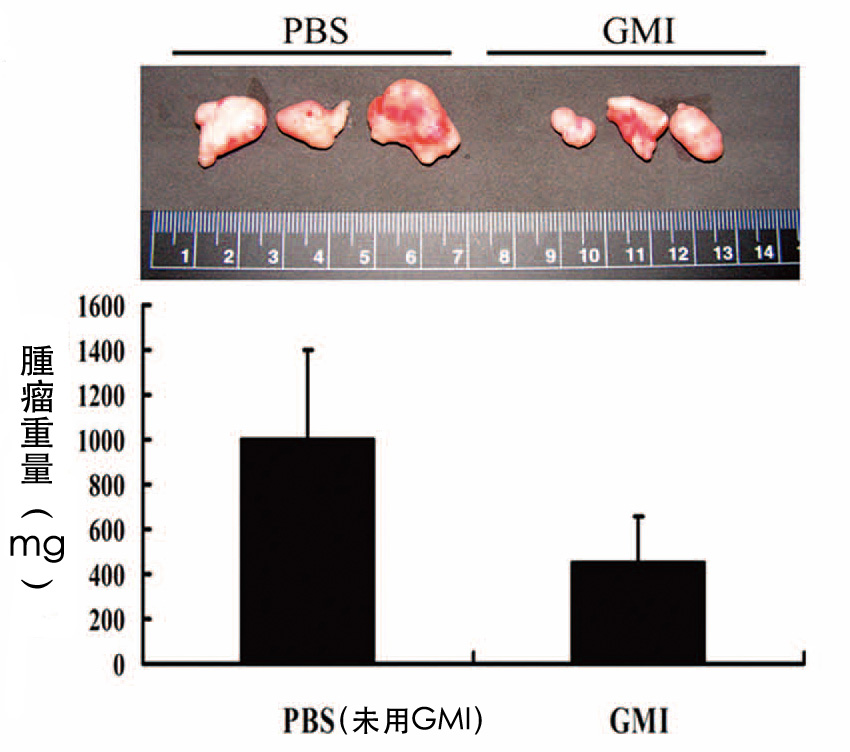
图1 灵芝蛋白GMI对裸鼠肺腺癌肿瘤的抑制作用
先将人类肺腺癌细胞株A549注射至裸鼠皮下,
五天之後再喂食小孢子灵芝蛋白GMI,每天160 μg(=0.16 mg),
在第六十六天实验结束时,GMI组的肿瘤体积不到对照组的三分之一(上图),
肿瘤重量也不到对照组的一半(下图)。
(资料来源/Autophagy. 2011 Aug 1;7(8):873-82. )
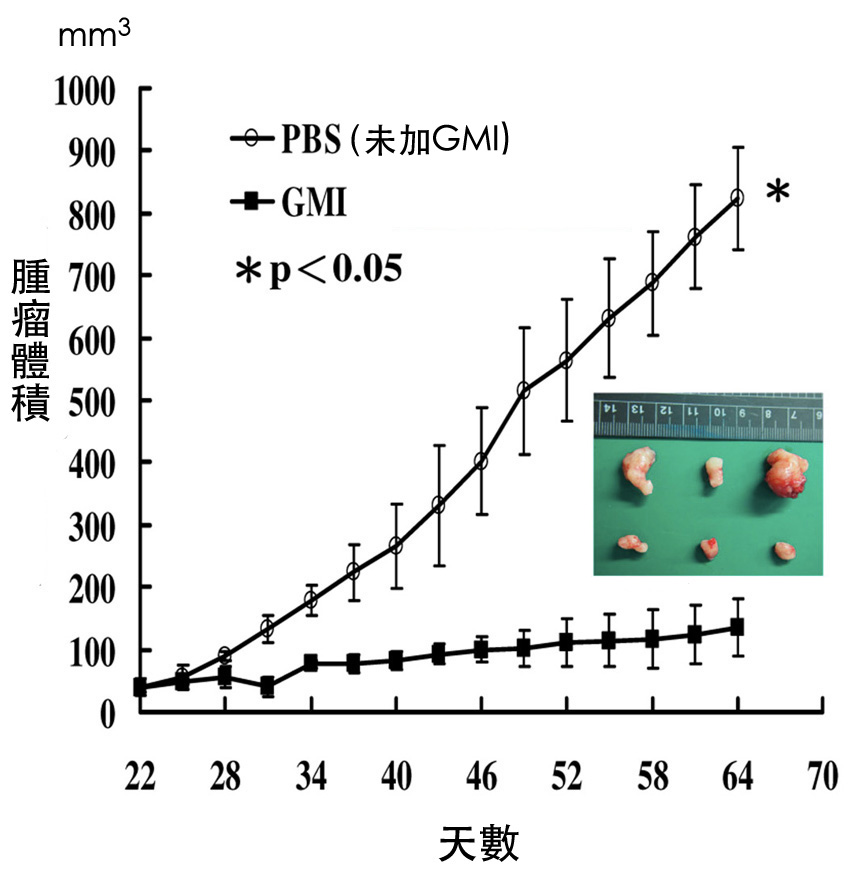
图2 灵芝蛋白GMI对抗药性肺肿瘤的抑制作用──早期治疗
先给裸鼠皮下注射「对欧洲紫杉醇有抗药性」的肺癌细胞A549/D16,
七天後再以管喂方式每天给予裸鼠160 μg(=0.16 mg)的GMI,
肿瘤生长会显着受到抑制。
(资料来源/PLoS One. 2015 May 6;10(5):e0125774.)
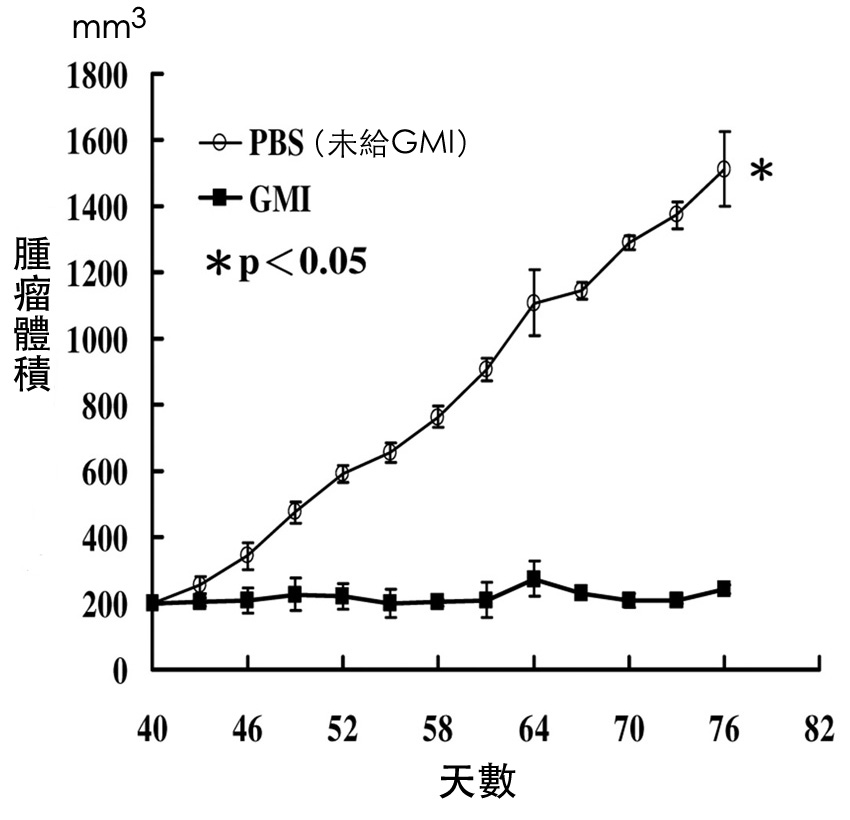
图3 灵芝蛋白GMI对抗药性肺肿瘤的抑制作用──长出肿瘤後再予治疗
先给裸鼠皮下注射「对欧洲紫杉醇有抗药性」的肺癌细胞A549/D16,
四十天後待肿瘤长到200 mm3的大小时,
再以管喂方式每天给予裸鼠160 μg(=0.16 mg)的GMI,
仍可有效抑制肿瘤生长(下面那条曲线)。
(资料来源/PLoS One. 2015 May 6;10(5):e0125774.)
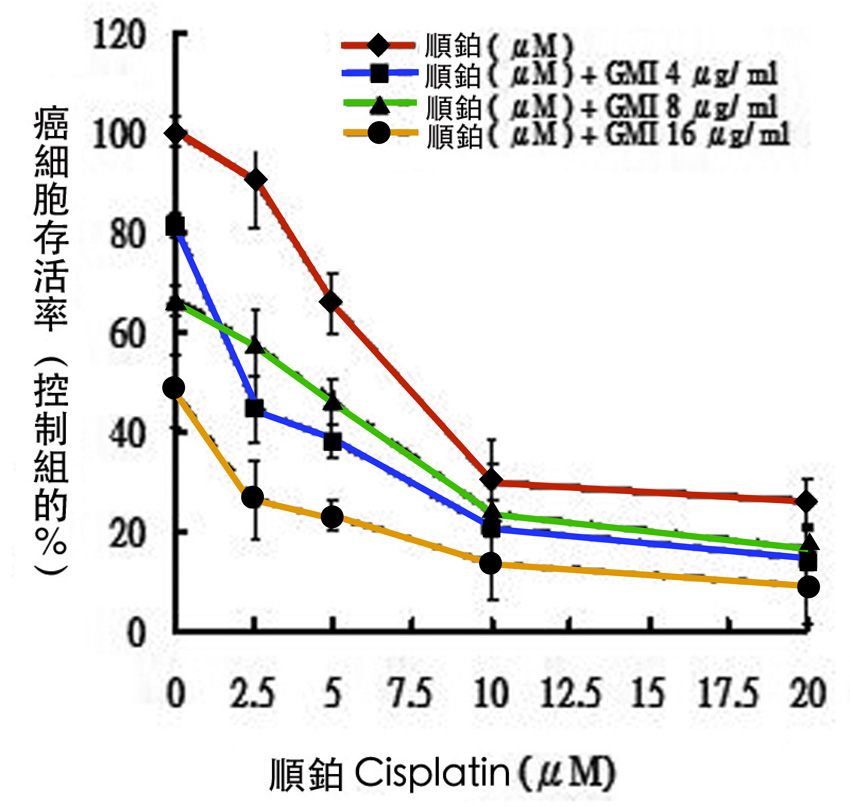
图4 「灵芝蛋白GMI + 顺铂」对肺癌细胞的抑制作用
以GMI(4、8、16 μg/ml)和顺铂(2.5~20 μM)
共同处理人类肺腺癌细胞株A549,结果发现,不管在哪个剂量下,
两者并用对癌细胞的毒杀效果都比单用顺铂强,
而且当顺铂剂量愈低时,GMI的协同作用愈显着。
(提供/柯俊良,重制/吴亭瑶)
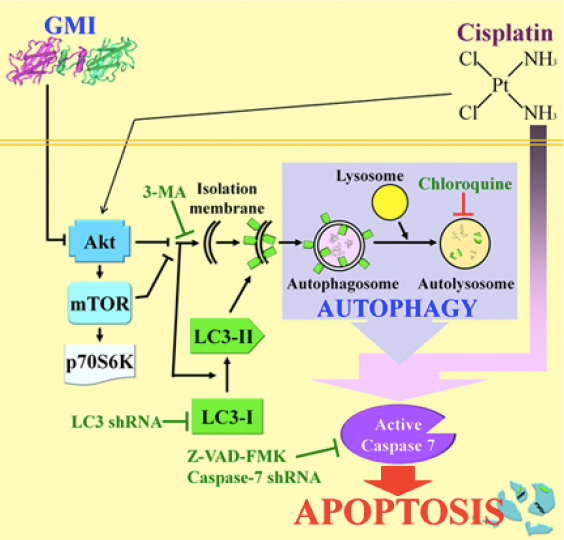
图5 「灵芝蛋白GMI」与「顺铂」调控肺癌细胞自噬作用的分子机制
(资料来源/Mol Pharm. 2015. 12(5):1534-43.)
松杉灵芝蛋白FIP-gts 对肺癌、泌尿道上皮癌也有效
其实不只小孢子灵芝蛋白GMI有上述作用,柯俊良也曾用松杉灵芝蛋白FIP-gts做肺癌的动物实验,虽然它和GMI的基因序列有17%的差异性,同样也是只要每天给肺癌裸鼠口服160 μg的小剂量,就有类似GMI的抑瘤效果(图6)。
除此之外,松杉灵芝蛋白FIP-gts也能启动泌尿道上皮癌细胞(不管有没有抗药性)的自噬作用,加速癌细胞的死亡【5、6】。柯俊良表示,好发於男性的泌尿道上皮癌(膀胱癌的一种),目前标准的第一线治疗药是含有铂金类的化疗药,一旦产生抗药性,尚无标准的第二线化疗药可供使用,因此灵芝蛋白的效果很值得期待。
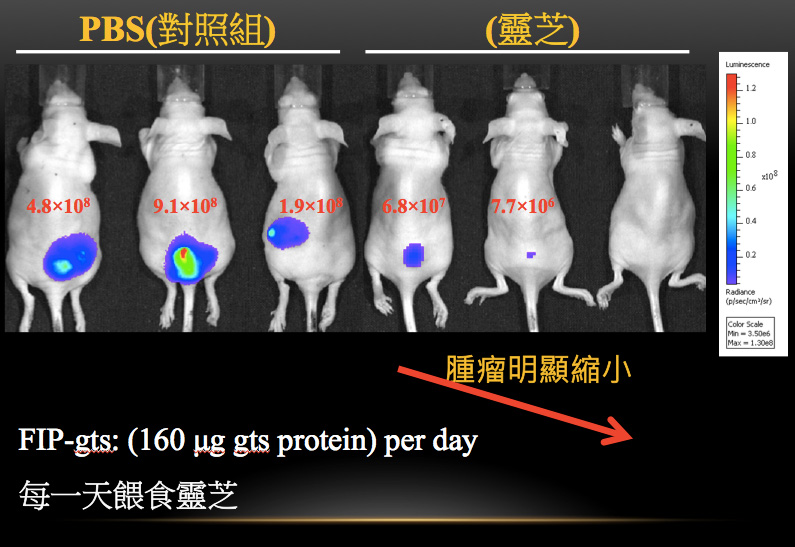
图6 灵芝蛋白FIP-gts对肺腺癌细胞的抑制作用
先将人类肺腺癌细胞株A549注射至裸鼠皮下,
五天之後再喂食松杉灵芝蛋白FIP-gts,每天只要160 μg(=0.16 mg)
即可有效抑制肿瘤生长。(提供/柯俊良)
细胞自噬作用,到底是让癌细胞生或死?
只是,如果促进癌细胞自噬,可以加速癌细胞死亡,那为什麽有些报导会说,「癌细胞为抵抗化疗,会透过细胞自噬求生……少部分癌细胞无法被清除、出现抗药性,推测与细胞自噬有关,将来若对癌症开发抑制细胞自噬药物搭配化疗使用,就有机会进一步清除顽强的癌细胞」,似乎与柯俊良的研究结果相冲突。
对此,柯俊良解释,当癌细胞启动自噬作用时,最後是生是死,要看它自噬到什麽程度,亦即癌细胞能否把它吃掉的部分进一步分解变成养分。有些癌细胞的分解能力很强,便可靠自噬作用求生,而出现所谓的抗药性。因此如果有一种药物可以调控细胞自噬过程的後半段,让癌细胞无法分解吃掉的东西,那麽自噬到後来的结果,癌细胞本身反而会被撑破或毒死。这就是媒体报导上所说的,利用「抑制细胞自噬」让癌细胞死亡的原理。
柯俊良说,其实灵芝蛋白既能透过基因调控,促使癌细胞出现自噬作用,也能阻止癌细胞在自噬过程中获得养分,所以才能在体外实验让癌细胞死亡率大增,也才能在体内实验让裸鼠的肿瘤长不大──不管这肿瘤有没有抗药性,也不管灵芝蛋白有没有与化疗药并用。
由於过去许多化疗药物大多是以「促凋亡」作为主要的攻击点,不少癌细胞已衍生出逃避凋亡机制的应对之道而产生抗药性,因此诱发癌细胞自吞的抗癌方式,无疑是癌症治疗的新利器。
灵芝蛋白的作用何止是「促进癌细胞自噬死亡」而已
不过更为柯俊良称道的是,灵芝蛋白还可保护正常细胞,减轻化疗药的伤害。去年(2015)发表的报告即证实,松杉灵芝蛋白FIP-gts减轻欧洲紫杉醇引发的多种副作用【7、8】。
欧洲紫杉醇常用於肺癌、乳癌的治疗,如果能将灵芝蛋白开发成临床用药,将造福多少病友啊!最重要的是,根据已经完成的毒理评估显示,灵芝蛋白的安全性很高,而且灵芝蛋白是单一成分,化学结构与基因序列也都完全清楚,还能进行大规模的工业化量产,所以现在只差做出更多的临床和机制研究,就有机会让癌症多一个治疗的希望。
研究灵芝蛋白超过二十年的柯俊良说,实在想不到一个小小的蛋白,有这麽多的作用。其实自从他发表灵芝蛋白和癌细胞自噬相关的论文後,许多灵芝研究团队也开始朝这个方向探讨。他们有的用不同来源的灵芝蛋白(如LZ-8、FIP-gat),有的用三萜类总萃取物、灵芝酸或赤芝酸,讨论的作用也锁定在抗肿瘤作用。有这麽多不同的研究团队和他有志一同,实在始料未及。
想当初,柯俊良之以会注意到灵芝蛋白与细胞自噬的关系,主要是因为灵芝蛋白对肺癌细胞的促凋亡作用很微弱,「但奇怪的是,那些因为癌细胞在出现衰老状态之後,经过一段较长的时间还是会死,所以才会想到,可能是『细胞自噬』这个机制。」只是为什麽原本长生不老的癌细胞会「衰老」?原来是灵芝蛋白阻断了癌细胞永保青春的源头──抑制癌细胞染色体的端粒酶活性。
「真的很巧,我研究细胞自噬没多久,大隅良典就因细胞自噬研究而获得诺贝尔医学奖;之前我研究端粒酶活性也是,也是研究结果出来没几年,就有学者因为研究端粒酶而获得诺贝尔医学奖。」果真如此,2009年的诺贝尔医学奖正是颁给三位「发现端粒和端粒酶如何保护染色体」的科学家,而柯俊良发表第一篇「灵芝蛋抑制肺癌细胞端粒酶活性」论文的年份则是2006年【9】。
哇~柯老师,您会预言吗?下回您要研究灵芝蛋白的什麽作用,来让我们大开眼界?也许未来几年的诺贝尔医学奖评审团,又会和您英雄所见略同呢!
延伸阅读
1. 〔许瑞祥2015演讲〕灵芝免疫调节蛋白的开发与应用
2. 灵芝免疫调节蛋白质研究之最新进展
3. 灵芝蛋白GMI提高顺铂疗效,肺癌细胞「自噬」与「凋亡」两头烧
4. 灵芝蛋白GMI促使「多重抗药性肺癌细胞」自噬而亡
5. 松杉灵芝免疫调节蛋白 减轻欧洲紫杉醇的化疗副作用
参考文献(灵芝蛋白)
1. Hsin IL, et al. GMI, an immunomodulatory protein from Ganoderma microsporum, induces autophagy in non-small cell lung cancer cells. Autophagy. 2011 Aug 1;7(8):873-82.
2. Hsin IL, et al. Inhibition of lysosome degradation on autophagosome formation and responses to GMI, an immunomodulatory protein from Ganoderma microsporum. Br J Pharmacol. 2012 Nov;167(6):1287-300. doi: 10.1111/j.1476-5381.2012.02073.x.
3. Chiu LY, et al. Immunomodulatory protein from Ganoderma microsporum induces pro-death autophagy through Akt-mTOR-p70S6K pathway inhibition in multidrug resistant lung cancer cells. PLoS One. 2015 May 6;10(5):e0125774. doi: 10.1371/journal.pone.0125774. eCollection 2015.
4. Hsin IL, et al. GMI, an immunomodulatory protein from Ganoderma microsporum, potentiates cisplatin-induced apoptosis via autophagy in lung cancer cells. Mol Pharm. 2015. 12(5):1534-43. doi: 10.1021/mp500840z.
5. Li JR, et al. FIP-gts potentiate autophagic cell death against cisplatin-resistant urothelial cancer cells. Anticancer Res. 2014 Jun;34(6):2973-83.
6. Hsin IL, et al. Immunomodulatory proteins FIP-gts and chloroquine induce caspase-independent cell death via autophagy for resensitizing cisplatin-resistant urothelial cancer cells. Phytomedicine. Available online 10 September 2016. doi: 10.1016/j.phymed.2016.09.003.
7. Ou CC, et al. Fungal immunomodulatory proteins alleviate docetaxel-induced adverse effects. Journal of Functional Foods. 2015 Sep; 19: 451-463.
8. 侯婷译,探讨真菌类免疫调节蛋白质改善欧洲紫杉醇引起的不良副作用。中山医学大学医学研究所硕士论文,2014。
9. Liao CH, et al. Transcriptionally mediated inhibition of telomerase of fungal immunomodulatory protein from Ganoderma tsugae in A549 human lung adenocarcinoma cell line. Mol Carcinog; 2006. 45(4):220-9.


