热休克蛋白的任务就是帮助细胞里其它蛋白维持正确的构形(功能),以确保细胞的存活与运作。少了热休克蛋白就像没了保护伞一样,生存能力将大受影响。根据阳明大学林东毅团队的最新发现,灵芝蛋白LZ-8和GMI能收走肺腺癌细胞的保护伞,减缓肿瘤的生长速度。这个新发现,为灵芝蛋白可以「多管齐下」抗肺癌的作用,提供了部分解释。
文/吴亭瑶
自从科学证明灵芝蛋白LZ-8(来自Ganoderma lucidum)和GMI(来自Ganoderma microsporum)能在体内抗肺癌以来,相关的作用机制就不断被发现:
◆ 抑制端粒酶活性,使肺癌细胞无法不断修复DNA而永生不死;
◆ 启动细胞自噬和凋亡机制,使肺癌细胞主动自我了结;
◆ 活化P53(肿瘤抑制基因/蛋白)使肺癌细胞能像正常细胞一样衰老凋亡;
◆ 抑制β-catenin(β链蛋白)引发的抗凋亡活性;
◆ 抑制EGFR(表皮生长因子受体)造成的癌细胞生长失控,而且对正常型、过表达型与突变型的EGFR都有效;
◆ 抑制EGF(表皮生长因子)对EGFR的活化,降低癌细胞的侵袭力与转移力;
◆ 抑制TFN-α(肿瘤坏死因子)对NF-kB(核转录因子)和MMP-9(基质金属蛋白酶)的活化,降低癌细胞的侵袭力与转移力;
◆ 抑制FAK(黏着斑激酶)引发的EMT(上皮细胞间质转化)现象,降低癌细胞从原组织松脱进而转移它处的机会。
从西药的角度思考,一种机制必须由一种药物负责,要完成上述任务,不知要开发多少新药才能全部都标靶到。可是「很不科学」的是,上述作用机制却是由一个「单一成分」独立完成,而且不论是LZ-8(由110个胺基酸组成)或GMI(由111个胺基酸组成)都有这种多管齐下的本领。
换句话说,癌细胞遇到标靶药还能转个弯另寻活路,以抗药性来展现它的顽强,可是一旦遇上的是LZ-8或GMI,转来转去都是死路一条,大概也只能放下屠刀立地成佛了。
不过,LZ-8和GMI的本事还不只上述如此。根据国立阳明大学传统医学研究所助理教授林东毅团队今年(2021)1月发表在《Phytomedicine》(植物医学期刊)的论文证实,LZ-8和GMI还能抑制肺癌细胞合成「热休克蛋白」,使肺癌细胞因为缺少「逆境求生必备的保护伞」而元气大伤、自废武功。
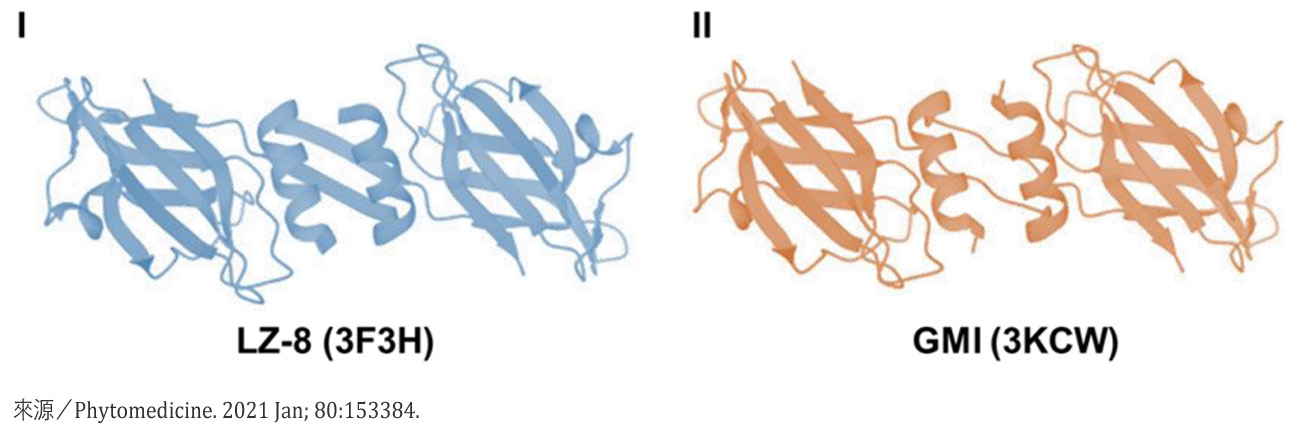
图1 两种具抗肿瘤活性的灵芝蛋白结构
什麽是「热休克蛋白」?
虽然名之为热休克蛋白(Heat Shock Proteins,简称HSP)──细胞受高热刺激而产生的蛋白──但其实任何来自外部环境的压力,都会刺激细胞合成这类蛋白,帮助细胞里其他蛋白能够折叠出正确的构形,维持构形的稳定(有正确稳定的构形才能发挥正常的功能),并把无法修复的错误蛋白送去资源回收,以确保细胞能够「处变不惊」的正常运作与存活。
正常细胞如此,癌细胞亦如是。在随时有免疫大军与药物夹杀的高压环境下,癌细胞甚至比正常细胞更需要热休克蛋白,才有办法灵活应变,夹缝求生。
所以,少了热休克蛋白就像失去保护伞一样,生存能力和作怪使坏的能力都将大受影响。这就是林东毅团队对於灵芝蛋白之所以能有效抑制肺癌的新发现。
灵芝蛋白抑制肺癌肿瘤生长
研究者先把肺腺癌细胞(LLC1)植入小鼠皮下,将此日设定为实验第0天,然後再於第3、7、11、15天以腹腔注射的方式把LZ-8送进小鼠体内,每天剂量7.5 mg/kg,并与控制组(注射等量的磷酸盐缓冲生理食盐水PBS)进行比较。
当实验在第17天结束时,两组小鼠的体重几乎差不多,但肿瘤体积却差了将近一倍(图2)。

图2 灵芝蛋白对肺腺癌肿瘤生长的抑制作用
灵芝蛋白降低热休克蛋白的表现量
取出小鼠身上的肿瘤组织进行分析,结果发现,LZ-8组里的热休克蛋白HSP60、HSP70和HSP90(包含α和β两种亚型)明显减少。
同样的结果可在体外实验看得更清楚:把5μg/mL的LZ-8或GMI加入小鼠肺腺癌细胞加入一起培养24小时,不仅癌细胞的存活能力和迁移能力大受影响(图3),其细胞凋亡率也大幅增加(图4)。此时癌细胞里的HSP60、HSP70、HSP90α表现量,LZ-8组分别只有控制组(未加入灵芝蛋白)的63%、52%、50%,GMI组更分别只有控制组的18%、37%和25%(图5)。

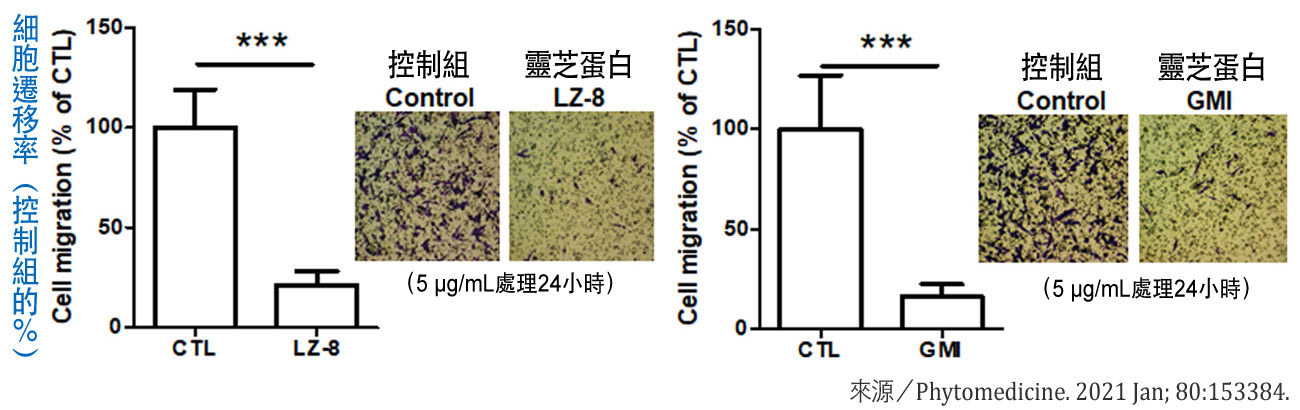
图3 灵芝蛋白对肺腺癌细胞存活与迁移的抑制作用
图4 灵芝蛋白对肺腺癌细胞的促凋亡作用

图5 灵芝蛋白对肺腺癌细胞合成热休克白的抑制作用
掐住热休克蛋白,就像掐住癌细胞的咽喉
HSP60、HSP70、HSP90里的数字,代表着不同分子量的热休克蛋白,它们对细胞的生存和转移,都扮演关键性的角色。
HSP60可以帮助素有细胞发电厂之称的粒线体正常产生能量,并藉此协助细胞内15~30%的蛋白进行折叠。因此它的减少会让癌细胞因为过多构形错误蛋白而受到损坏,进而启动控管细胞品质的凋亡机制,使癌细胞凋亡而死。
HSP70会将折叠错误的细胞蛋白质降解,并标上「注销」的记号,让它们可以被送去「资源回收厂」水解成基本单位(胺基酸)重新被细胞利用。因此HSP70的存在既可防止细胞因品质不良而启动凋亡机制,也可防止细胞因营养缺乏而启动自噬机制;少了它的穿针引线,将会大幅提高癌细胞凋亡和自噬的机会。
HSP90管辖的范围又比前面两者更大了,除了有些功能和前面两者重复外,癌细胞用来增生、侵袭或转移的许多蛋白──像是过度表达的受体蛋白EGFR、Her2、ALK、KRAS,调节细胞生长的信号传导蛋白PI3K、AKT,肿瘤血管新生和癌转移所需的蛋白VEGF、MMP2,乃至癌基因突变产生的突变蛋白──都需要HSP90帮忙稳定构形。因此它的减少会让这些蛋白分子难以发挥功能,肿瘤生长恶化的机会也会大大降低。
图6 热休克蛋白的立体构形
(图片来源/Wikimedia Commons: HSP70, HSP90)
如果你有兴趣再回顾文章一开始提到的,先前已被证实的一长串灵芝蛋白抗肺癌机制,不难发现,其中很多都与HSP60、HSP70、HSP90减少有关。同样身为小分子蛋白的LZ-8和GMI,竟能一把掐住它们,让肺癌细胞少了保护伞的撑腰而自废多项武功,颇有「打蛇打七寸」的奥妙。
标靶热休克蛋白已被视为是下一个抗癌新药的大热门,因为比起目前多数标靶药总是难逃癌细胞基因突变而导致药效失灵的缺点,把热休克蛋白当作目标显然能突破现有标靶治疗的困境。
LZ-8和GMI究竟是用什麽方式让癌细胞里的热休克蛋白减产,还需要进一步厘清。会不会除了肺腺癌之外的癌细胞,灵芝蛋白也有抑制热休克蛋白的作用呢?令人拭目以待。
〔资料来源〕Tung-Yi Lin, et al. Functional proteomic analysis reveals that fungal immunomodulatory protein reduced expressions of heat shock proteins correlates to apoptosis in lung cancer cells. Phytomedicine. 2021 Jan; 80:153384. doi: 10.1016/j.phymed.2020.153384.
〔延伸阅读〕中山医学大学柯俊良教授、阳明大学许先业教授对灵芝蛋白抗肺癌的研究成果


