可以被GMI助攻的抗癌搭挡又多了一个!2020年7月柯俊良团队发表在《Journal of Cellular Physiology》的论文证明,小孢灵芝免疫调节蛋白GMI可以与口服剂型的Src酪胺酸激酶抑制剂「塞卡替尼(saracatinib)」发挥协同作用,提高对肺腺癌细胞的杀伤力,为GMI辅助癌症治疗的科学证据再添一笔。
文/吴亭瑶

自从2009年中山医学大学柯俊良教授的团队发现小孢子灵芝免疫调节蛋白质GMI(Ganoderma microsporum immunomodulatory protein)具有抗肺癌活性以来,GMI就不断被证明,既能单独应用抗肿瘤,也能协同其他抗癌药物发挥加乘效果。
包括顺铂、紫杉醇、小红莓等传统化疗药,艾瑞莎(EGFR抑制剂)、西妥昔单抗(EGFR单株抗体)、西达本胺(HDAC抑制剂)等标靶药物,氯奎宁(抗疟疾)、酮康唑(抗霉菌)、丝裂霉素C(抗生素)等化学药物,以及吉舒达(免疫检查点抑制剂)等免疫药物,都被证明可以因为GMI的加入而大幅提升抗癌效能。
其实药物的并用和人与人之间的合作很像,联手出击未必一定就力量大,有时弄巧不成反而还会变成彼此的猪队友。因此,能在不同组合下发挥各种神助攻的GMI还真不是只有一把刷子;更厉害的是,不管刷子怎麽刷都不会伤到正常细胞。
如今,可以被GMI神助攻的抗癌搭挡又多了一个。今年(2020)七月柯俊良团队发表在《Journal of Cellular Physiology》(细胞生理学期刊)的论文证明,GMI可以与口服剂型的Src酪胺酸激酶抑制剂「塞卡替尼(saracatinib)」发挥协同作用,提高对肺腺癌细胞的杀伤力──不论癌细胞有没有抗药性。
Scr酪胺酸激酶,细胞增生的加速器
酪胺酸激酶(tyrosine kinase)是一群可以调控细胞生长的蛋白分子,而由Scr基因生成的十多种Src蛋白,即是其中的一大类。
在大多数的细胞中Scr存在得很低调,但在某些癌细胞里Scr则有异常活化(活性很强)和过度表现(分泌量高)的问题。由於Scr会进一步活化它的下游分子,促进细胞快速增生,因此抑制失控的Src就成了癌症标靶治疗的对策。
只不过,虽然塞卡替尼可以抑制Src活性,但它对晚期和已经转移的非小细胞肺癌,却没有很好的治疗效果。
单用塞卡替尼不足成事,那麽,和GMI一起联手出击呢?
左图:GMI的立体构形(提供/许瑞祥)。
右图:塞卡替尼的化学结构(来源/维基百科)。
提高毒杀癌细胞的效果
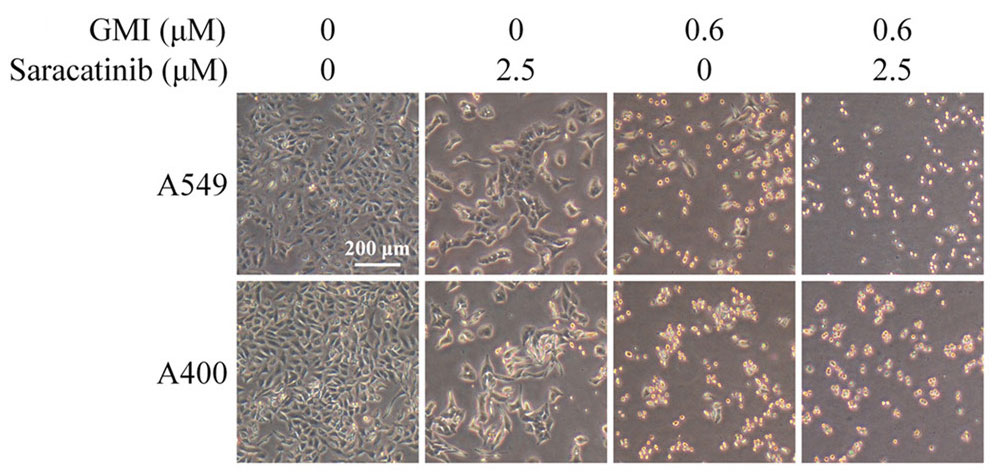
柯俊良团队使用两种人类肺腺癌细胞株进行评估,一种是没有抗药性的A549,一种是对非小细胞肺癌第一线化疗药爱达宁(pemetrexed)具有抗药性的A400。
结果发现,同样都是与A549肺腺癌细胞作用48小时的时间,当只有GMI(0.6μM)时,癌细胞的死亡率是48.3%;只有塞卡替尼(2.5μM)时,癌细胞的死亡率是15.8%;两者一起并用时,癌细胞的死亡率则上升到57.5%。
把癌细胞换成具有抗药性的A400,其他实验条件不变,得到的结果则是:只有GMI或塞卡替尼时,癌细胞的死亡率分别是56.9%和19.2%;一旦两者并用,则能把癌细胞死亡率提升到71.4%。
也就是说,不管肺腺癌细胞抗不抗药,GMI本身就有很好的毒杀作用,但如果能与塞卡替尼并用,癌细胞会更难生存。
显微镜底下的人类肺腺癌细胞株A549(无抗药性)和A400(有抗药性)。同样经过48小时的处理,没有塞卡替尼(saracatinib)、也没有GMI介入的癌细胞长得密密麻麻(最左栏);加入塞卡替尼或GMI的癌细胞数量明显减少(中间两栏);同时被GMI和塞卡替尼夹击的癌细胞数量则更加稀疏(最右栏)。
「促自噬」与「促凋亡」左右开弓
为什麽塞卡替尼与GMI联手,可以毒杀更多的肺腺癌细胞?经柯俊良团队的研究发现:
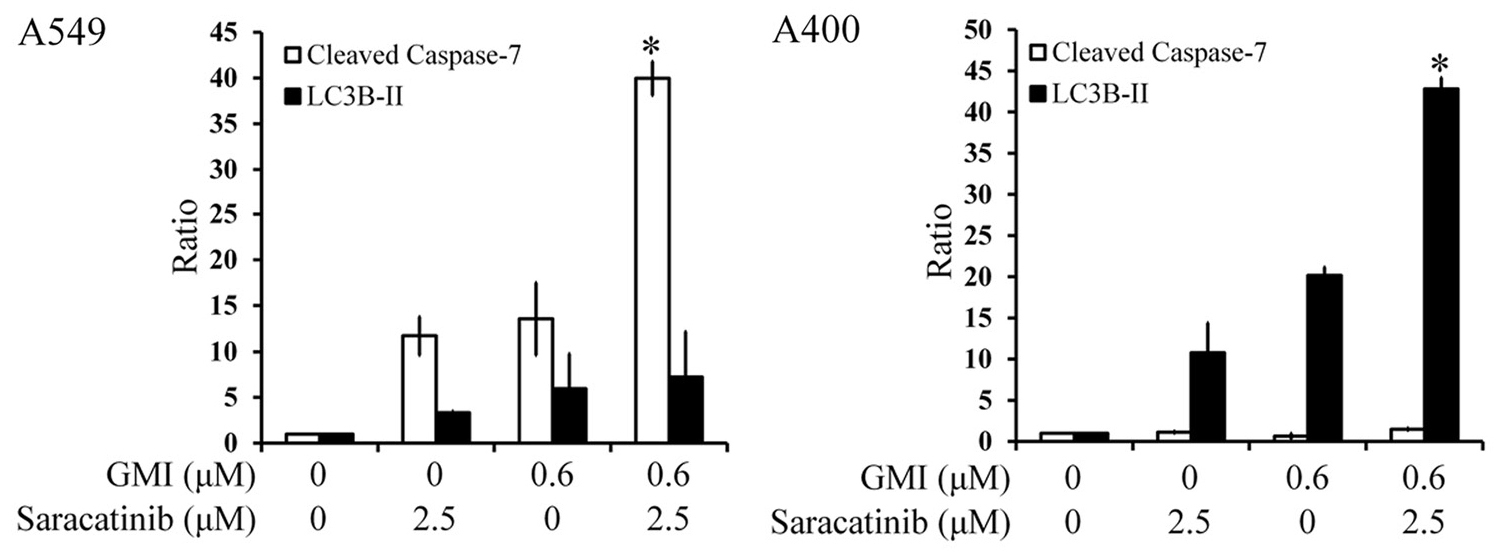
塞卡替尼抑制Src酪胺酸激酶的作用「并没有」因为GMI的加入而变得更强,可是它们的联手却能促使不具抗药性的A549通过「细胞凋亡机制」自我了断,并且促使具有抗药性的A400通过「细胞自噬机制」自取灭亡。
人类肺腺癌细胞株A549(无抗药性)和A400(有抗药性)经不同方式处理48小时後出现的细胞凋亡指标(cleaved caspase-7)和细胞自噬指标(LC3BⅡ)。实验结果显示,GMI与塞卡替尼(saracatinib)并用可以让A549的细胞凋亡活性大幅增加,也能让细胞自噬活性小幅增加,但对於A400则只会大力促进细胞自噬的表现。
「细胞凋亡」是身体为了维持生命品质淘汰老化或异常的细胞启动的计画性死亡,是正常细胞才有的本事。因此,当原本「抗凋亡」的癌细胞变得可以凋亡时,癌细胞无疑就像一般正常细胞不再可怕。
「细胞自噬」则是细胞在压力或饥饿胁迫下自体吞噬的求生本能,最後是死是活,必须看紧急状态有没有办法在细胞功能尚可正常运作前即时缓解。正常细胞和癌细胞都能在情急下使出这个大绝招。从癌症治疗的角度来看,如果细胞自噬执行得不够彻底,原本被逼入绝境的癌细胞反而有机会死里逃生,卷土重来。
所幸柯俊良团队的研究证明,具有抗药性的A400肺腺癌细胞在被「GMI+塞卡替尼」启动细胞自噬机制之後,细胞最後会自噬而亡。
至於不具抗药性的A549肺腺癌细胞,虽然终结在细胞凋亡之下,但其实「GMI+塞卡替尼」一开始对它启动的机制也是细胞自噬。只是不同於A400的自噬到底,A549则是在自噬的过程中,不小心让细胞正常运作的功能大当机,结果触动了管控细胞品质的细胞凋亡机制,最後只好走上自我了结一途。
百搭的GMI,最佳的神队友
在新药开发不易、临床用药有限的现实条件下,GMI可以与各种不同的抗癌药物分进合击、借力使力,无疑为有限的癌症治疗带来更多的希望。
GMI与塞卡地尼并用的研究不仅为肺腺癌的治疗开发更多可能性,也让我们看到协同搭挡作战的GMI,在面对不同路数的癌细胞时见招拆招、各个击破的能耐。
许多具有抗药性的癌细胞都是因为它的细胞凋亡机制无法被药物启动,才变得那麽难搞。因此,GMI另辟蹊径启动不同程度的细胞自噬,把癌细胞铤而走险赌一把的机会都没收了,显然是对付这类癌细胞的好方法。
此外,GMI与塞卡地尼的协同作用,对於始终无法成为正式临床抗癌用药的塞卡地尼,也极具意义。
虽然先前许多研究都已证明塞卡地尼的药物安全性和口服耐受性,但後来却因为抗癌疗效不够明显,临床试验仅做到第二阶段就被开发它的阿斯利康硬生生喊卡(咦,阿斯利康?好像在哪里听过?没错,就是那个在COVID-19疫苗开发竞赛中带领英国队领先群雄的英国药厂AstraZeneca)。
新药开发如此困难、昂贵,怎能就此作罢?因此药厂先後又把塞卡地尼转往阿兹海默症和巴金森氏症的领域进行临床试验。阿兹海默的临床研究已因疗效不佳和副作用明显而宣告暂停,而巴金森氏症的第一阶段临床研究则至少要等到2021年9月才会揭晓。
药厂的不肯放弃某种程度说明了塞卡地尼已具备临床用药的基本条件,只是在功效表现上老是欠缺东风。柯俊良团队的研究成果已让世人看到,有GMI助攻的塞卡替尼彷佛升级成2.0版。塞卡地尼有没有可能借着GMI咸鱼翻身,成为可以真正应用在临床治疗的标靶利器呢?还真令人期待。
〔研究新知〕Chiu LY, et al. Combination treatment of Src inhibitor Saracatinib with GMI, a Ganoderma microsporum immunomodulatory protein, induce synthetic lethality via autophagy and apoptosis in lung cancer cells. J Cell Physiol. 2021 Feb;236(2):1148-1157. doi: 10.1002/jcp.29924. Epub 2020 Jul 19.