由中兴大学、丰原医院、台中荣民总医院等台湾多所研究机构联合发表在《International Journal of Molecular Sciences》的研究证明:具有抗肿瘤和免疫调节活性的小孢子灵芝免疫调节蛋白质GMI,可以降低神经组织发炎、保护神经细胞存活,对於治疗神经退化性疾病和神经系统损伤相关疾病,深具潜力。
文/吴亭瑶

不需多说,大家都知道,那些包含帕金森氏症、阿兹海默症、中风在内的「与神经细胞退化或死亡」相关的疾病,对人类健康和生活品质的威胁有多大。其无药可治,且患病率和死亡率年复一年上升的情况,比起「至少有药可挑,且死亡率逐年降低」的癌症还要严峻。
没有人能精准预测未来等在自己前方的,是细胞异常增生到影响正常器官运作的癌症,还是神经细胞退化、死亡引发的认知或行动障碍。因此,完美的想像或许是:如果有一个安全如食品的东西,能够一兼二顾的击退两大类疾病,不知该有多好?
2018年尾声,由中兴大学、丰原医院、台中荣民总医院、静宜大学、中山医学大学、弘光科技大学、中国医药大学等台湾多所研究机构联合发表在《International Journal of Molecular Sciences》的研究报告,为我们带来了希望:
该研究证明,具有抗肿瘤和免疫调节活性的小孢子灵芝免疫调节蛋白质GMI(Ganoderma microsporum immunomodulatory protein),可以降低神经组织发炎、保护神经细胞存活,对於治疗神经退化性疾病和神经系统损伤相关疾病,深具潜力。
小胶质细胞→过度的发炎反应→神经细胞功能退化或死亡
帕金森氏症和控制运动的神经细胞受损有关,阿兹海默症与认知记忆的神经细胞受损有关,还有中风後可能出现的认知功能衰退或行动障碍,这三种疾病表面上看起来症状不同(损伤的神经细胞掌管的功能不同),病程长短也各有快慢(前二者为慢性病,後者为急症),背後却有共通的病理机制──不是大量神经细胞功能退化,就是大量神经细胞死亡。
过度的发炎反应被认为是神经细胞功能退化或死亡的源头。因此,不管发炎反应的诱发因素是什麽,只要能把发炎反应降下来,就能减少神经细胞受到的损伤。
体内许多地方的发炎反应都可能影响神经细胞的功能与存活,但影响最为直接和关键的,主要还是与神经细胞长相左右的小胶质细胞(microglia)。
是的。位於中枢神经系统(脑和脊髓)的神经细胞并非单独存在,而是和一群统称为「胶质细胞」(glial cell)或「神经胶质细胞」(neuroglial cell)的细胞们相互依存。以人脑来说,这些胶质细胞和神经细胞的比例大约是十比一之多。正因为有它们分工合作提供各种支持、滋养和保护,神经细胞才能发挥正常的功能。
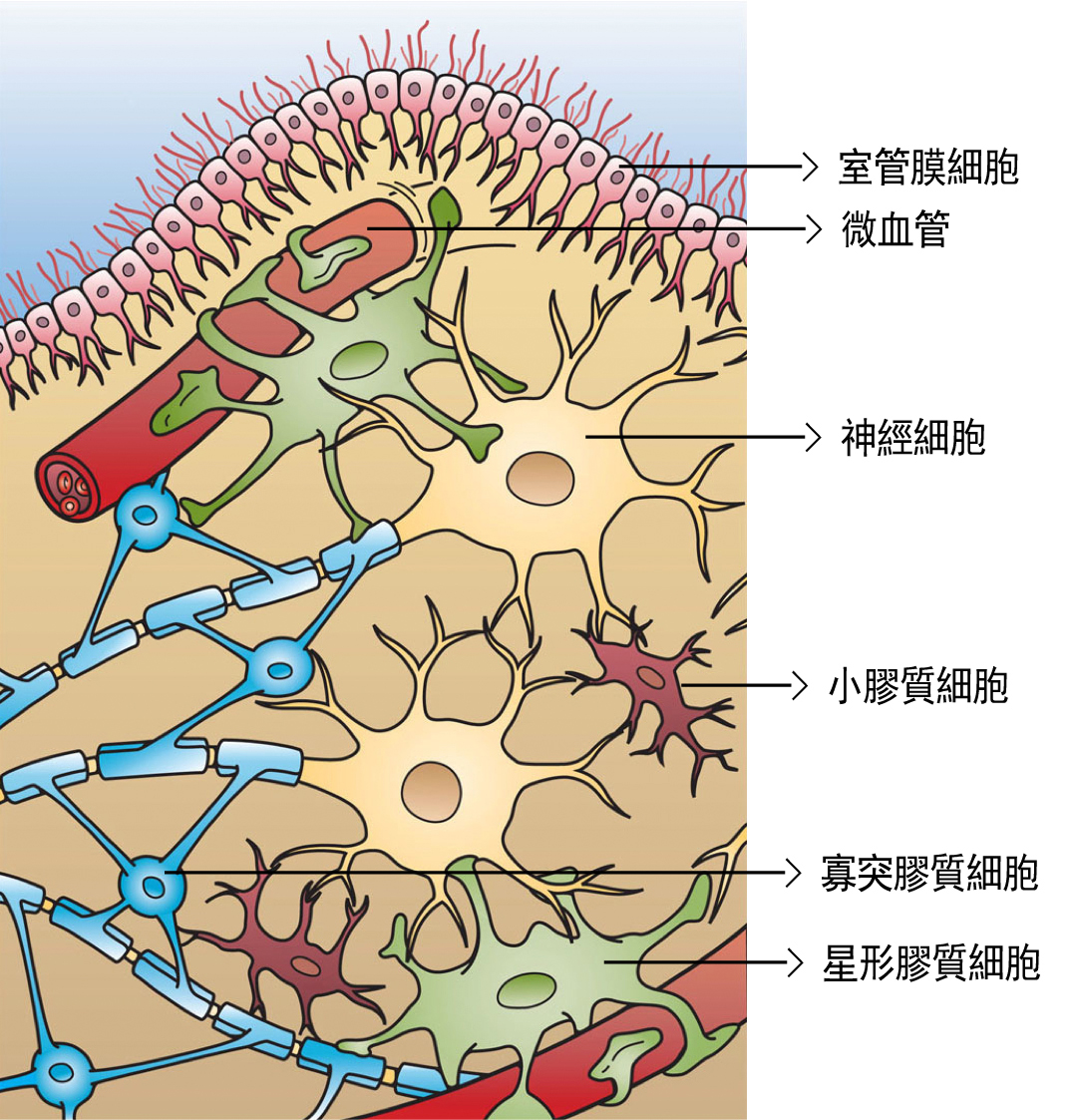
图1 中枢神经组织的基本组成:神经细胞和胶质细胞
在中枢神经组织中,神经细胞受到各种不同功能的胶质细胞支持、滋养和保护。这些胶质细胞包括:室管膜细胞、寡突胶质细胞、星形胶质细胞,以及本篇研究报告的主角,和发炎反应最为相关的小胶质细胞。(资料来源/维基共享资源媒体文件资料库:File:Glial Cell Types.png)
在这群胶质细胞中,小胶质细胞和发炎反应最相关,因为它就像是免疫系统中的巨噬细胞,负责清除(吞噬)入侵神经系统的病原体和受损的神经细胞。
适度活化的小胶质细胞有助於维持神经系统的衡定,但过度活化的小胶质细胞则会释放各种不同的促发炎介质,对神经细胞造成损害。
因此,想要让神经退化性疾病或相关的神经系统损伤获得妥善的治疗,能否有效调控小胶质细胞的发炎反应,就成了重要的标的。
GMI减少神经细胞死亡
为了解GMI在这方面的能耐,由中兴大学等多所台湾研究机构组成的团队,直接把大鼠的大脑皮质神经组织取出,与GMI在体外进行一系列的实验:
研究者先把包含神经细胞与胶质细胞在内的神经组织,与GMI一起培养30分钟,再加入可以诱发发炎反应的LPS/IFN-γ(脂多醣和干扰素γ的混合液)一起培养48小时。
脂多醣是细菌细胞壁的主要组成,干扰素γ则是动物细胞受到病毒感染後所分泌的具有抗病毒功能的醣蛋白,两者都有刺激发炎反应的作用,因此大鼠的脑神经组织在经过LPS/IFN-γ作用之後,神经细胞存活的数量会大幅减少,细胞外观形态和完整性也受到显着破坏(图2右上图)。
反观事先有GMI保护者,尤其是事先以2 μg/mL剂量的GMI处理过的大鼠脑神经组织,神经细胞受损的灾情相对减轻很多(图2右下图)。
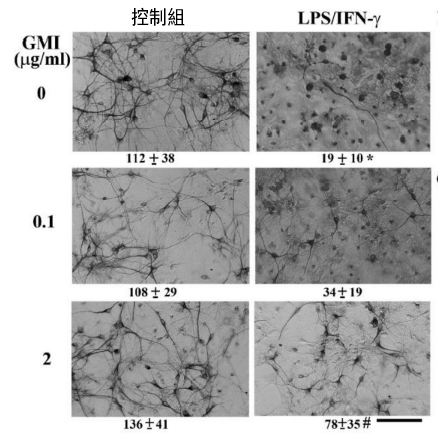
图2 GMI减少神经细胞死亡的数量
〔说明〕实验方法如上述内文所述。每张图下方的数字为神经细胞存活的数量。数据右上角标示「*」表示与「未添加LPS/IFN-γ和GMI」的控制组相比有显着差异,p < 0.05;数据右上角标示「#」表示与「只添加LPS/IFN-γ,未添加GMI(剂量为0)」的组别相比有显着差异,p < 0.05。右下图下方的横杠代表60 μm。
GMI抑制小胶质细胞增生
再者,LPS/IFN-γ会刺激小胶质细胞增生(如图3右上图),而当小胶质细胞数量愈多,发炎反应也将更加剧烈。但如果事先以GMI处理大鼠的神经组织,则小胶质细胞增生的情况会受到显着的抑制(如图3右下图)。
相较之下,同样是属於胶质细胞家族的星形胶质细胞(其功能很多,包括:提供神经细胞所需的营养,引导神经细胞去到他们应该到达的地方,支持和固定神经细胞的位置,形成血脑障壁等等),其存活数量和细胞完整性则不受LPS/IFN-γ或GMI影响。
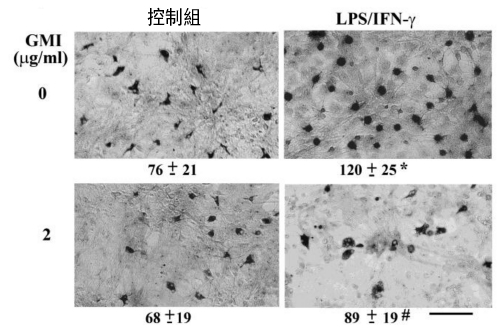
图3 GMI抑制小胶质细胞增生
〔说明〕与图2同。
GMI抑制发炎介质生成
进一步检测大鼠脑神经组织(包含神经细胞与胶质细胞)在经过LPS/IFN-γ刺激24小时後所分泌的发炎介质。结果发现,事先以2 μg/mL GMI处理的神经组织,不论是NO(一氧化氮)、TNF-α(肿瘤坏死因子)、IL-1β(介白素1-β)和PGE2(前列腺素E2),分泌量都显着减少(如图4)。
这表示GMI能降低神经组织的发炎反应,而且可以用2 μg/mL的极微小剂量,发挥足以媲美10 μM Genistein(金雀异黄酮)的效果(如图4)。
Genistein是大豆里的其中一种异黄酮化合物,被认为具有抗氧化和抗发炎活性,因此实验以此物质做比较,可以评估GMI的抗发炎能耐到底如何。以「1 μM=2.54*105 μg/mL」公式换算10 μM的Genistein,不难想像其有效剂量与GMI的差距有多大。当所需的有效剂量愈小,未来在应用上当然愈具经济效益。
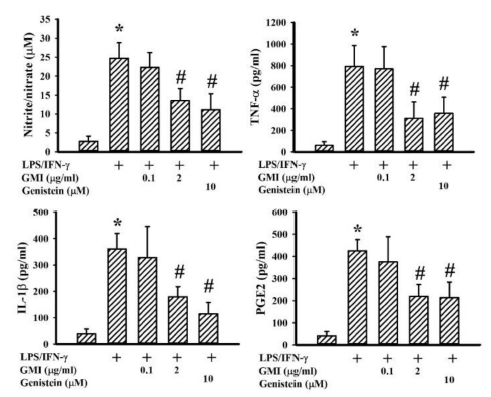
图4 GMI降低发炎介质的分泌量
〔说明〕标示「*」者表示数据与「未添加LPS/IFN-γ、GMI和Genistein」的控制组相比有显着差异,p < 0.05;标示「#」者表示数据与「只添加LPS/IFN-γ,未添加GMI或Genistein」相比有显着差异,p < 0.05。
GMI直接调控小胶质细胞内的分子,抗发炎也抗氧化
前面呈现的都是「从外面世界看细胞」的实验结果,至於「细胞内部的微观世界」又有哪些变化呢?研究者透过细胞分子层次的分析有了以下发现:
首先,经过GMI处理的小胶质细胞比较不易被LPS/IFN-γ活化──这也是为什麽GMI可以抑制小胶质细胞增生的原因之一。
与此同时,小胶质细胞内一系列和发炎相关的转录因子(NF-kB、AP-1、CREB、Stat1),以及许多参与发炎反应讯息传递的蛋白分子(ERK、JNK、p38、Akt、Jak、Src、COX-2、NF-kB),也都因为GMI的缘故而不易被LPS/IFN-γ激活。
反倒是会因为LPS/IFN-γ而降低活性的蛋白酪氨酸磷酸酶(protein tyrosine phosphatase)和丝胺酸/苏胺酸磷酸酶(serine/threonine phosphatase),可以在GMI的保护下维持既有的活性。由於这些酶类有助於稳定小胶质细胞内和发炎反应讯息传递相关的蛋白分子,因此GMI在这方面的作用,可被视为是GMI抑制小胶质细胞发炎反应的重要机制之一。
看到这里,不知你有否发现,GMI就是有办法逆转LPS/IFN-γ对於发炎反应的煽风点火。其实实验也观察到,连容易因LPS/IFN-γ刺激而升高的氧化压力,也会受到GMI压制。由於氧化压力不仅会助长发炎反应的气焰,还会致神经细胞於死地,因此GMI的抗氧化作用对於神经细胞的保护极具意义。
GMI防治「慢性神经退化疾病」或「急性神经系统损伤」的应用,值得进一步探究
GMI从发现到近几年应用於临床辅助肿瘤治疗,已经将近二十年了。这个由111个胺基酸组成、分子量在一万出头的小分子蛋白,已被证实可以通过胃酸和肠液等消化酵素考验,以口服方式进到体内发挥调节免疫和抗肿瘤等作用。如今,其对神经细胞保护作用的再获证实,无疑为GMI应用在维护人类健康的可能性再添一笔。
事实上已有研究证明,光是缓和周边血液里的发炎反应,就能对神经细胞功能退化或神经细胞死亡造成的疾病有所助益。这点对GMI来说不成问题,倒是它在进入血液循环之後,是否也能直接对大脑神经组织中的小胶质细胞进行调控,则须进一步以动物体内实验加以验证。
根据过去的医学认知,大脑和血管之间有道「血脑障壁(或称血脑屏障)」会像围墙般会选择性的阻止血液里的某些物质进入大脑;然而近几年通过更精密的仪器检测则发现,血脑障壁并非死板板的铜墙铁壁一块,而是不断在「活动」的──有细胞在血管与大脑之间互相沟通和穿梭的。(参考文章:打开血脑障壁,科学人杂志,2013)
让我们一起期待进一步的实验结果。也许击退帕金森氏症、阿滋海默症,乃至中风引发的认知退化或行动障碍等各种和神经细胞功能退化或死亡相关疾病的希望,就在这个「也能击退肿瘤」的GMI里。
〔资料来源〕Chen WY, et al. Anti-inflammatory and Neuroprotective Effects of Fungal Immunomodulatory Protein Involving Microglial Inhibition. Int J Mol Sci. 2018 Nov 21; 19 (11).


