2018年11月9日/河南大学淮河医院/Cellular Physiology and Biochemistry


由河南大学淮河医院表在2018年11月《Cellular Physiology and Biochemistry》(细胞生物学与生物化学)的研究报告证实,灵芝酸A有助减缓缺氧导致的大鼠心肌细胞损伤。
从灵芝三萜分离出的灵芝酸A(ganoderic acid A,简称GAA)早已被证实具有多种疗效,例如能抑制肿瘤生成、抑制HIV活性或保护肝脏等,然而关於灵芝酸A能否保护缺氧所致的心肌细胞损伤,科学上仍尚未有清楚了解。
冠状动脉疾病包含稳定型心绞痛、非稳定型心绞痛、心肌梗塞与突发性心脏休克。虽然目前医疗在诊断治疗冠状动脉疾病比起十年前已进步许多,但全球还是有相当多人死於此类疾病。其中,心肌梗塞(也称心肌梗死)最主要是由於心脏缺血、缺氧导致心肌细胞坏死所造成。也就是说,心肌细胞长期缺氧累积的伤害,会诱导心肌细胞的凋亡,进而引发心肌梗塞。
目前已知心肌细胞中的微小核醣核酸-182-5p(miR-182-5p)会保护大鼠不因心肌缺氧而导致心肌细胞坏死,因此本研究除了探讨灵芝酸A对於大鼠心肌细胞在缺氧状态下的保护作用,也进一步分析其作用机制是否与微小核醣核酸-182-5p有关。
灵芝酸A减轻缺氧对大鼠心肌细胞造成的损伤
实验显示,在缺氧环境下把大鼠心肌细胞H9c2与不同浓度的灵芝酸A一起培养12小时後,随着灵芝酸A浓度的提高,细胞存活率会跟着上升(图1A),细胞中活化生长的因子表现量也比缺氧情况下的细胞来得高(图1B);走向凋亡的细胞数量也会跟着下降(图1C),诱导细胞凋亡的相关因子也会因为灵芝酸A的作用而降低(图1D)。
此结果说明了,灵芝酸A能减轻心肌细胞在缺氧状态下的损伤程度,并且抑制心肌细胞凋亡。
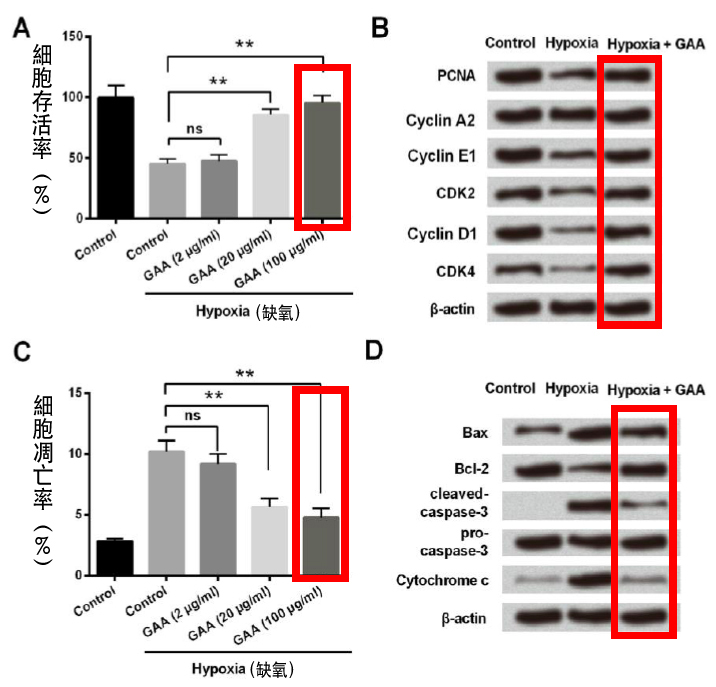
图1 灵芝酸A(GAA)对大鼠心肌细胞在缺氧环境下具有保护作用。
灵芝酸A调控miR-182-5p,保护心肌细胞
前面提过,心肌细胞内的微小核醣核酸-182-5p(miR-182-5p)可保护大鼠心肌不因缺氧而坏死,而根据研究者的实验显示,大鼠心肌细胞内的miR-182-5p表现量会在有灵芝酸A的条件下明显提升(图2)。
但如果事先以「miR-182-5p抑制剂」让大鼠心肌细胞内的miR-182-5p无法表现,再加入灵芝酸A,则灵芝酸A的添加既无法提高心肌细胞在缺氧环境下的存活率(图3B),亦无法提高活化细胞增生因子的表现量(图3C),细胞凋亡的比例(图3D)与相关细胞凋亡诱导因子的表现量(图3E)也与没有添加灵芝酸的控制组(缺氧受损的大鼠心肌细胞)没有差异。
这些结果说明了,灵芝酸A确实是能透过活化miR-182-5p的表现,来降低缺氧对细胞所造成的伤害。
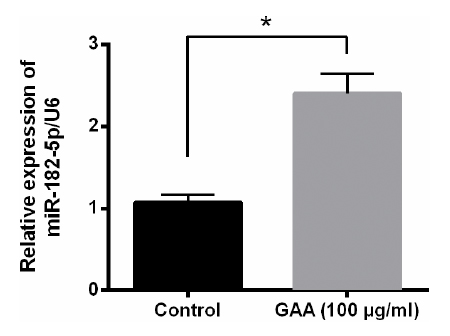
图2 灵芝酸A(GAA)对大鼠心肌细胞内miR-182-5p的调节作用。
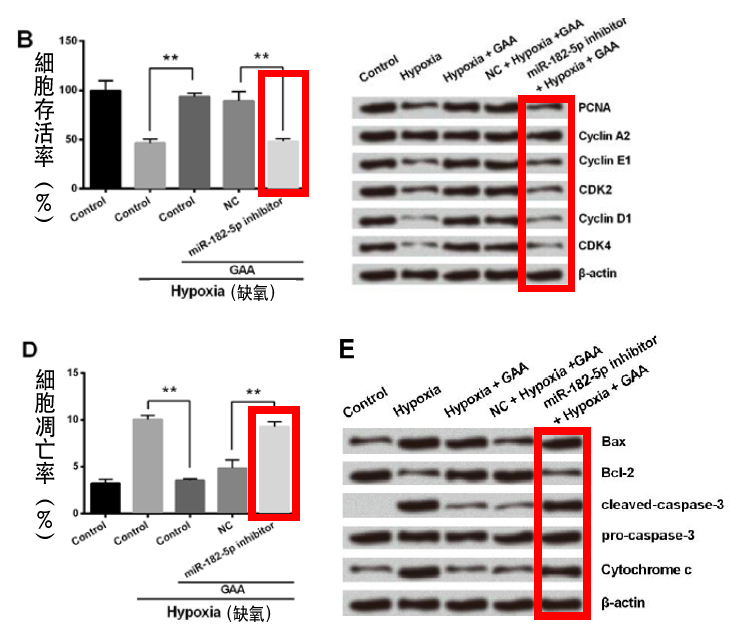
图3 当miR-182-5p受到抑制时,灵芝酸A(GAA)会对大鼠心肌细胞失去保护作用。
灵芝酸A→上调miR-182-5p→抑制PTEN表现→活化PI3K/AKT路径(→抑制心肌细胞凋亡)
由於过去已有其他研究指出,抑制心肌细胞内的PTEN蛋白(phosphatase and tensin homolog,磷酸酯酶与张力蛋白同源物)的表现,也可促进心肌细胞的存活,因此本研究的研究者又进一步探讨了灵芝酸上调miR-182-5p之後,对於PTEN蛋白,以及受PTEN影响的PI3K/AKT讯息传递路径会发生什麽变化。(编按:PI3K/AKT讯息传递路径可调控细胞增生与凋亡)
实验结果显示,miR-182-5p的有无,确实会影响PTEN的表现──当miR-182-5p受到抑制时PTEN的基因和蛋白表现量会上升,但在miR-182-5p有表现的情况下,PTEN的基因和蛋白表现量则会明显下降(图4A和B)。
实验也发现,在缺氧环境下的大鼠心肌细胞中加入灵芝酸A之後,大鼠心肌细胞中的PTEN蛋白表现量会下降,PI3K和AKT蛋白表现量则会增加(图4C)。(编按:当PI3K/AKT被活化时,会对细胞凋亡发挥抑制作用。)
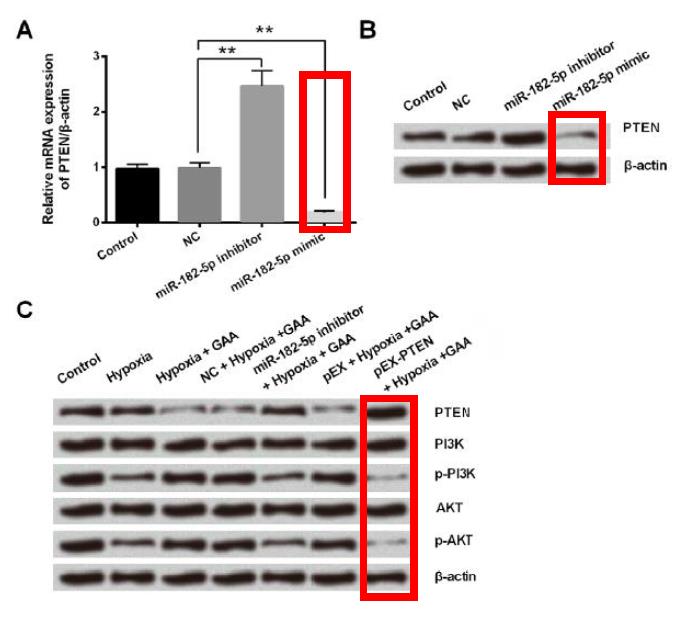
图4 miR-182-5p对PTEN基因表现(图A)和蛋白表现量(图B)的影响,以及灵芝酸A(GAA)对大鼠心肌细胞PTEN、PI3K、AKT蛋白的调控作用(图C)。
灵芝酸A保护心肌细胞的作用,能应用在心肌梗塞的治疗?
综合上述实验结果可知,灵芝酸A会透过增加微小核醣核酸miR-182-5p与降低PTEN的表现,来活化P13K/AKT讯息传递路径。此作用机制,应是灵芝酸A之所以能在缺氧的环境下维持心肌细胞的存活、抑制心肌细胞的凋亡的原因之一。
此研究成果有助於我们进了解灵芝酸A对於心肌梗塞的保护作用,也为灵芝酸A治疗心肌梗塞的临床应用提供了理论基础,值得进一步探究。
〔资料来源〕Zhang X, et al. Ganoderic Acid A Protects Rat H9c2 Cardiomyocytes from Hypoxia-Induced Injury via Up-Regulating miR-182-5p. Cell Physiol Biochem. 2018;50(6):2086-2096. doi: 10.1159/000495053. Epub 2018 Nov 9.


