早在1970年代科学家发现灵芝有很好的保肝作用。透过林志彬教授的这篇文章可以得知,灵芝对肝脏的保护,除了来自灵芝三萜的抗氧化作用和抗病毒作用,灵芝多醣的免疫调节作用也在其中扮演重要角色。而在临床应用方面,灵芝对於慢性B型肝炎的治疗效果更胜一般常用的中药制剂,以灵芝辅助西药治疗慢性B型肝炎的效果,也比单用西药来得更显着。
文/林志彬(北京大学药理学系教授)
◎本文原载於2013年《健康灵芝》第60期6~10页

北京大学药理学系林志彬教授从1970年代就开始投入灵芝研究,
灵芝保肝作用就是他主要的研究课题之一。(摄影/吴亭瑶)
Part1 药理研究发现灵芝的护肝作用及其机制
灵芝护肝作用的发现
早在1970年代初,我们在研究灵芝子实体制剂的药理作用时,即发现灵芝子实体酒精提取物,能减轻四氯化碳(CCl4)肝损伤小鼠的肝脏病理组织学损伤程度,并能增强肝损伤小鼠肝脏的解毒功能(1)。
随後一系列药理研究证明,灵芝子实体、菌丝体、孢子粉提取物可明显减轻CCl4、dl-乙硫胺酸(dl-Ethionine)、D-半乳糖胺(D-gal)、酒精等引起的小鼠实验性肝损伤,降低丙胺酸氨基转移酶(ALT)活性,减轻肝脏的病理组织学损伤程度。灵芝多醣还可预防肝纤维化,避免或减轻一些药物引起的肝损伤。
灵芝三萜──灵芝护肝作用的主要有效成分
(1) 灵芝三萜对免疫性肝损伤有保护作用
从灵芝子实体中提取的三萜类化合物,是灵芝保肝作用的重要有效成分。它们除了对CCL4和D-半乳糖胺引起的肝损伤有明显保护作用外,还对「卡介苗(BCG)+脂多醣(LPS)」引起的免疫性肝损伤有明显保护作用。
我们发现,灵芝总三萜(GT)和三萜组成分(GT2)可明显降低「BCG+LPS」诱发肝损伤小鼠的ALT和三酸甘油酯(TG),且GT2的有效剂量明显低於临床常用的保肝药马洛替酯(malotilate)。
(2)「抗氧化」是灵芝三萜保肝作用的重要来源
灵芝三萜类的保肝功效与其抗氧化作用密切相关。灵芝三萜类在降低因CCl4和D-半乳糖胺肝损伤升高ALT的同时,还会降低脂质过氧化产物丙二醛(MDA)含量,并使肝损伤时降低的肝脏超氧化物歧化酶(SOD)活性和还原型麸胱甘肽(GSH)含量显着升高【图1】(2)。
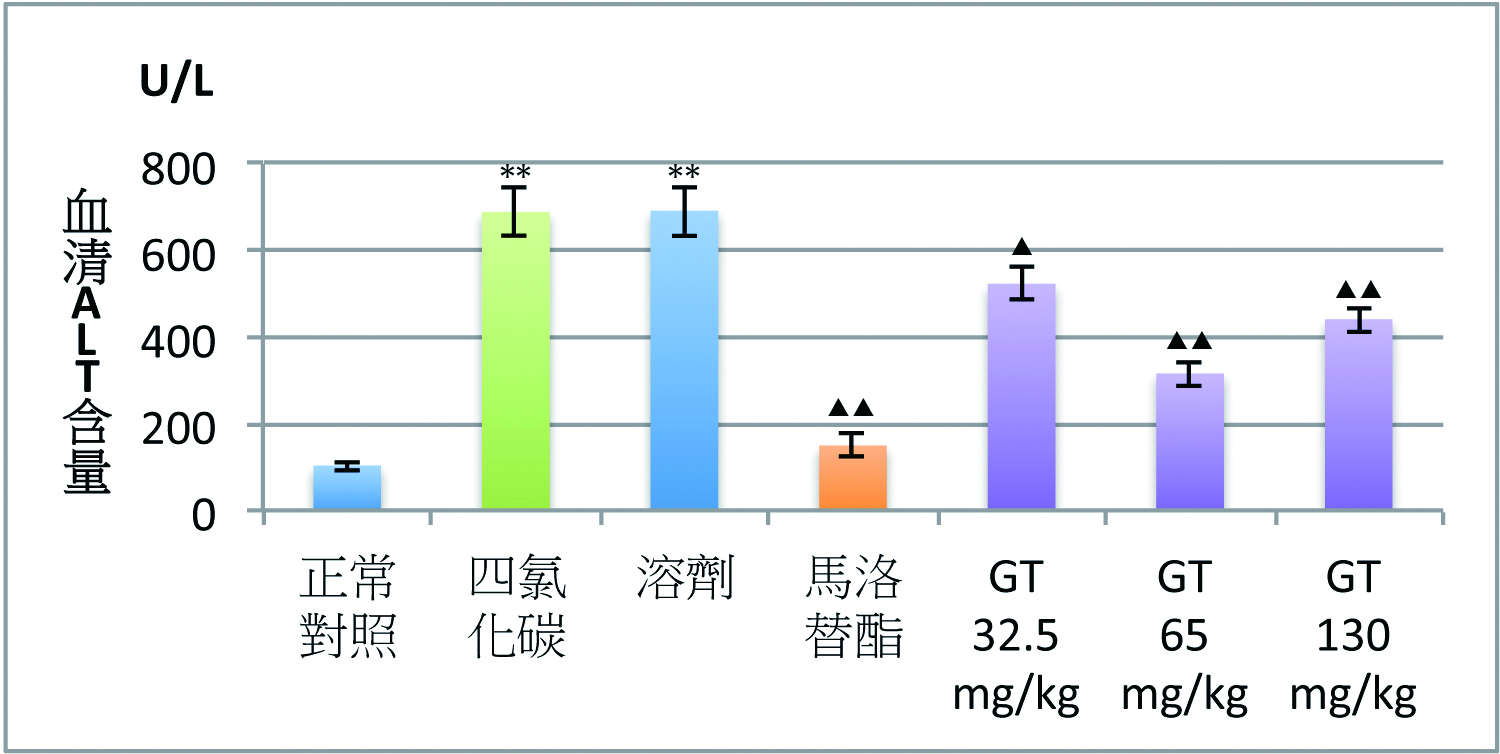
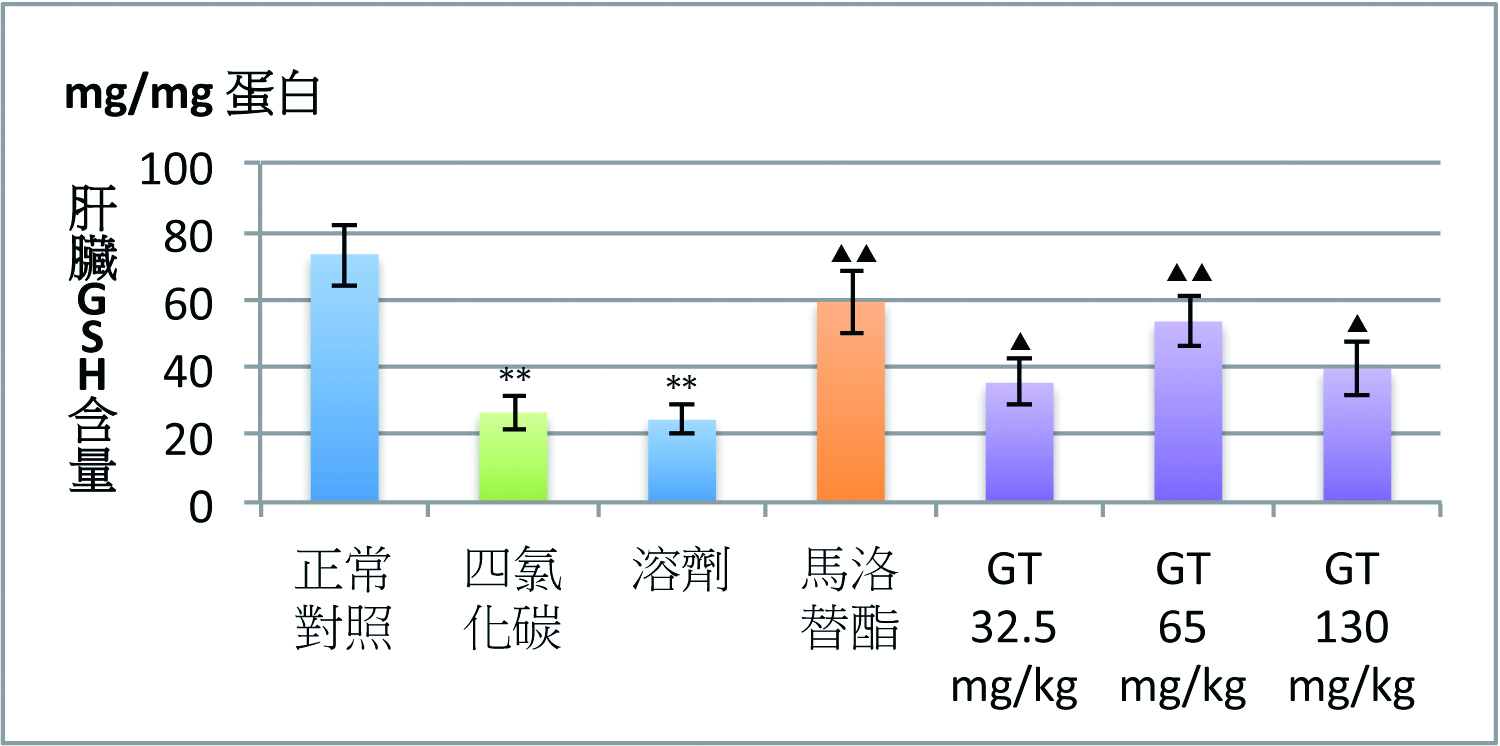
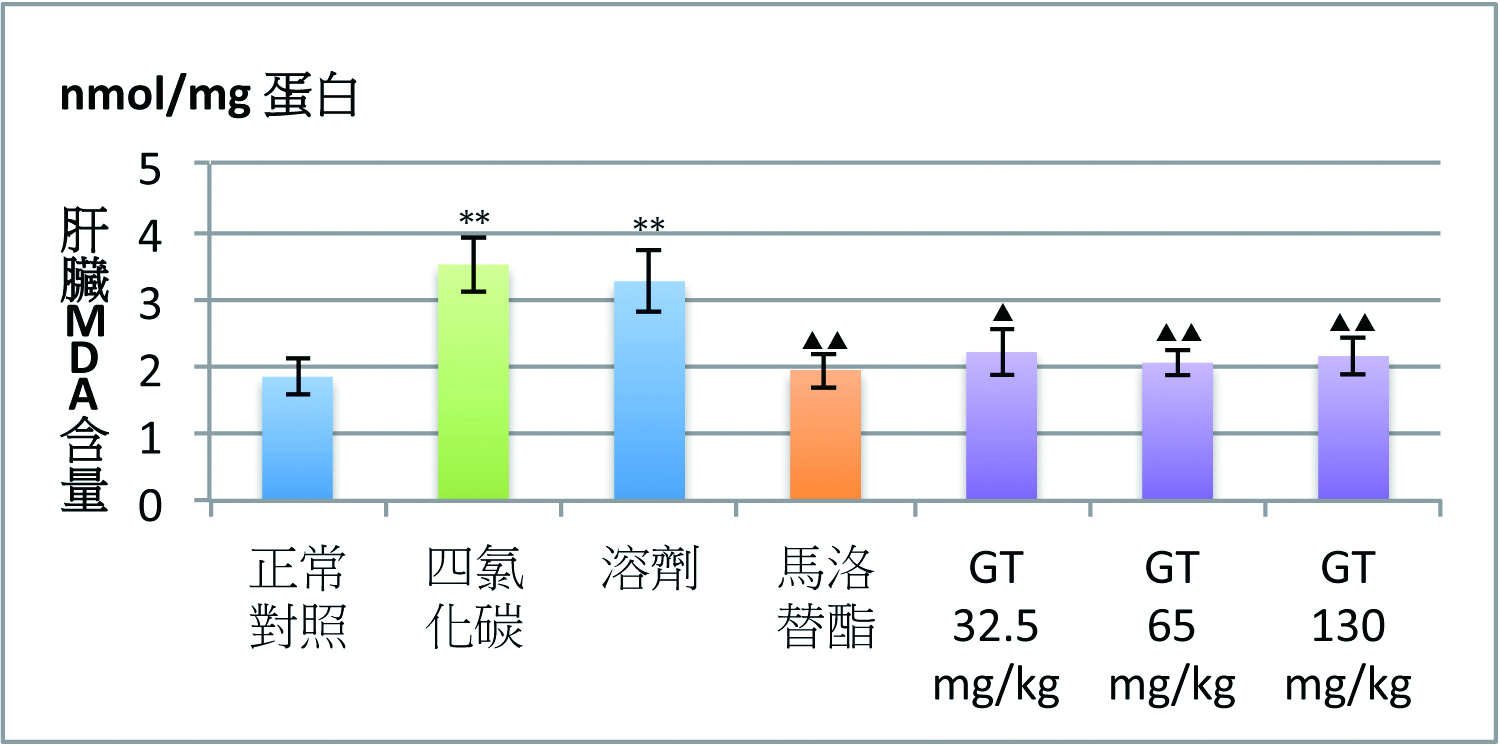
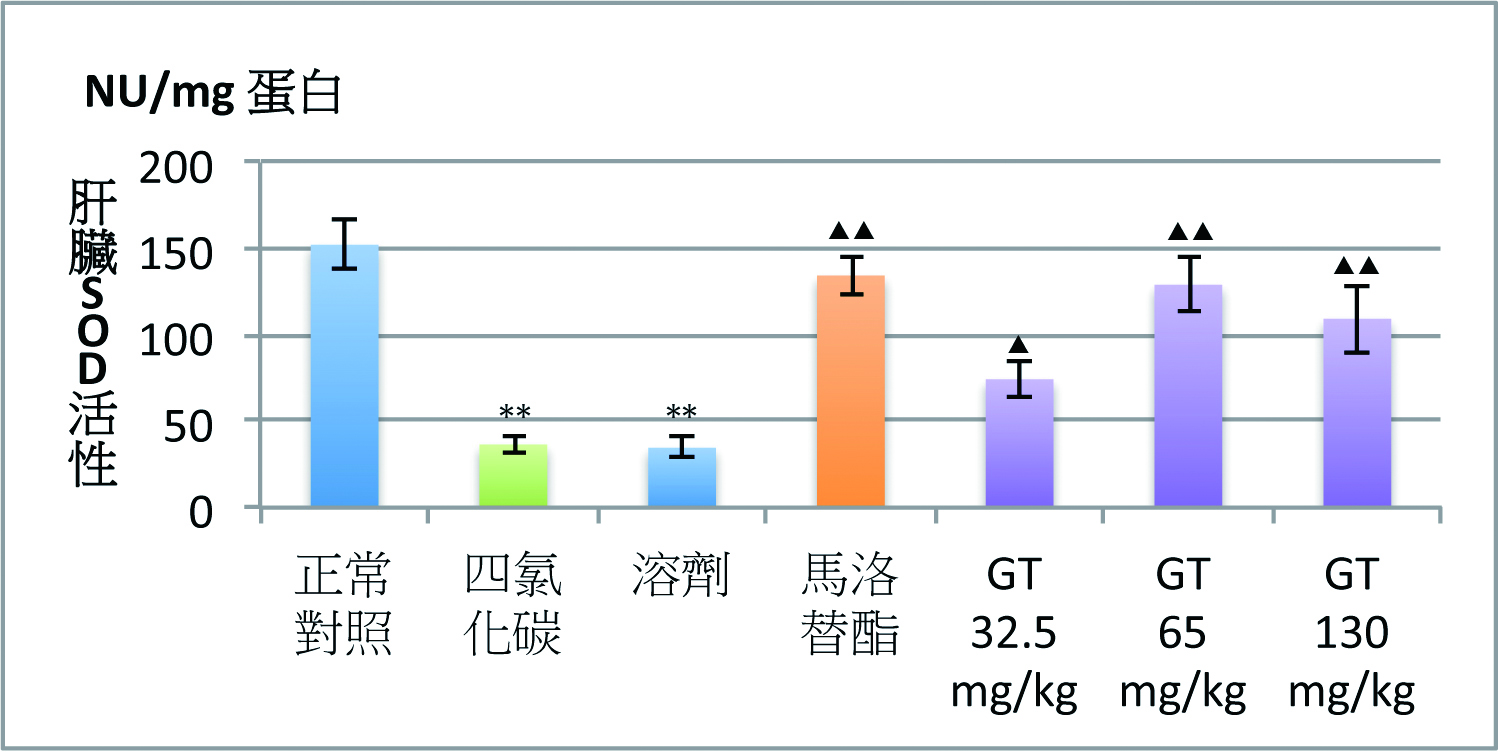
图1 灵芝三萜对四氯化碳(CCl4)肝损伤小鼠血清ALT
及肝脏MDA、GSH含量和SOD活性的影响
【注】CMC:溶剂。Mal:马洛替酯(阳性对照药)。n=9,x±s;
*P<0.05、**P<0.01,与正常对照组比较;
▲P<0.05、▲▲P<0.01,与CCl4组比较。
(制图/吴亭瑶)
(3) 灵芝三萜能抑制B型肝炎病毒复制
灵芝三萜类是否能抑制肝炎病毒?Li 等(2006)观察灵芝酸(ganoderic acid)在体外的抗B型肝炎病毒(HBV)活性。
研究采用的HepG2215细胞株来源於转染了HBV-DNA的人类肝癌HepG2细胞株,该细胞株可表达B型肝炎病毒表面抗原(HBsAg,即病毒的外套)、B型肝炎病毒e抗原(HBeAg,即病毒的制造物)、以及B型肝炎病毒的结构蛋白,能够稳定地产生B型肝炎病毒成熟颗粒。
结果显示,灵芝酸可抑制HBsAg和HBeAg的表达和产生【图2】,表示灵芝酸抑制了肝细胞中B型肝炎病毒的复制,但对肝细胞无毒性(3)。
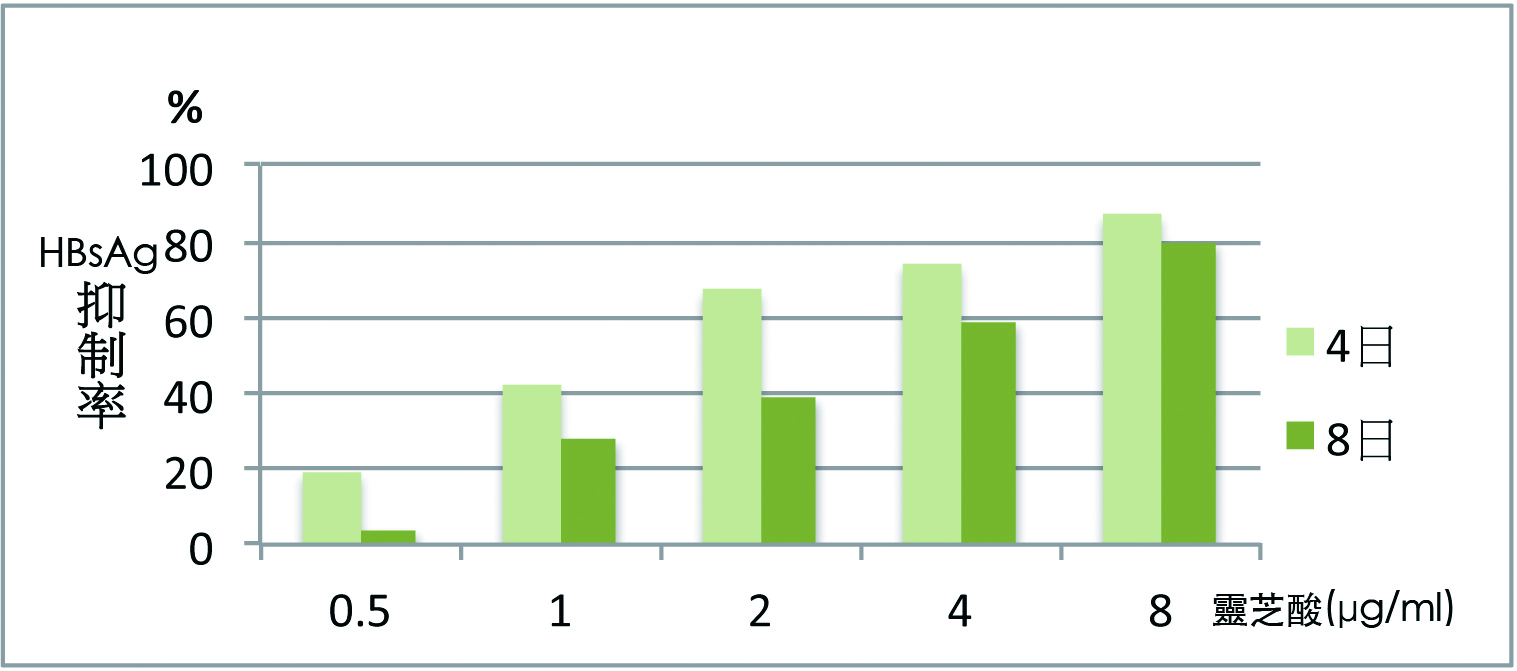
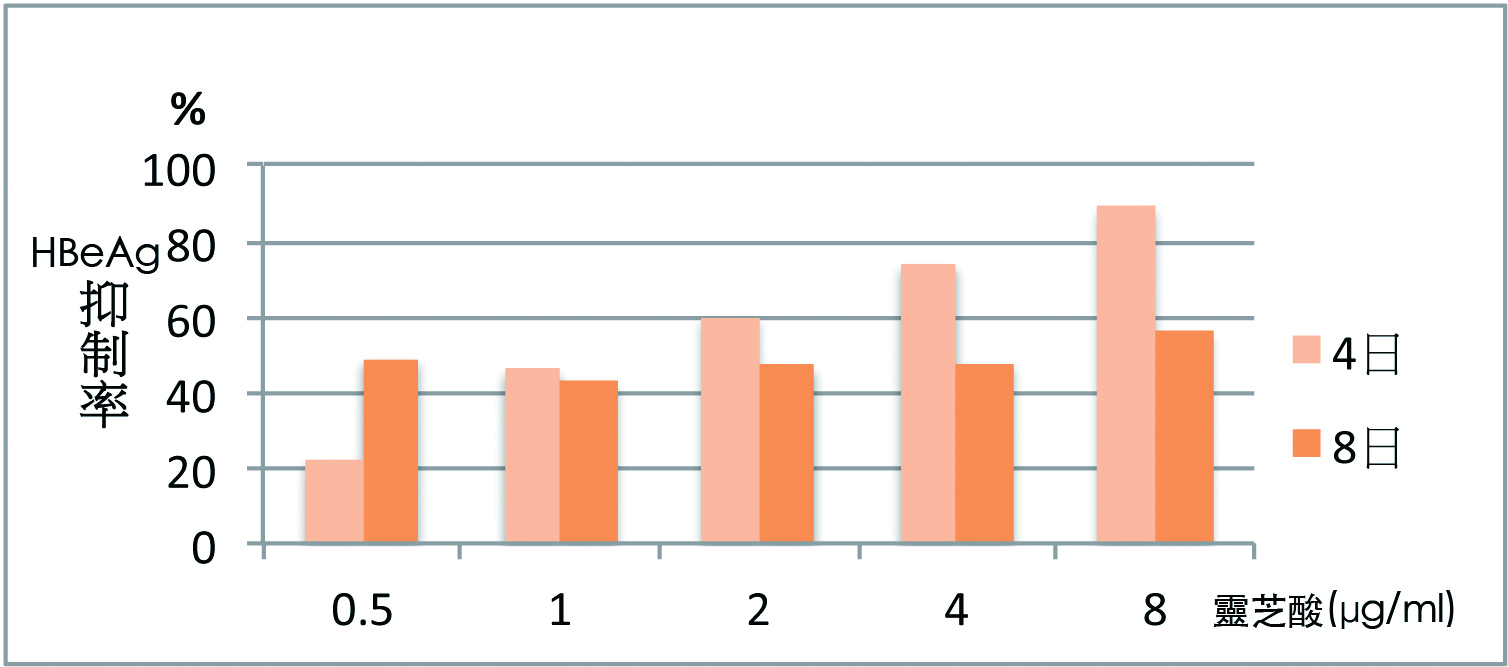
图2 灵芝酸对B型肝炎病毒抗原的抑制率
及对HepG2215细胞的毒性发生率
(制图/吴亭瑶)
灵芝的免疫调节作用在护肝中扮演要角
灵芝的免疫调节作用亦参与其防治肝炎的机制。灵芝提取物及其所含的灵芝多醣,均能增强单核巨噬细胞、NK细胞和T、B淋巴细胞的功能,还能促进免疫细胞激素如白介质2(IL-2)、干扰素γ(IFN-γ)的合成与释放,并因此纠正肝炎时的免疫功能紊乱,及通过免疫细胞和细胞激素(如IFN-γ)杀灭肝炎病毒,这是灵芝护肝作用的另一机制。
Part2 灵芝对B型肝炎的临床疗效
1970年代中国大陆即开始用灵芝制剂治疗慢性B型病毒性肝炎(以下简称慢性B型肝炎),综合各家报导,总有效率为73.1~97.0%,显效(包括临床治癒率)为44.0~76.5%,其疗效表现为:
主观症状(如乏力、食慾不振、腹胀及肝区疼痛)减轻或消失,肝功能指数(如血清ALT)恢复正常或降低,肿大的肝、脾恢复正常或有不同程度的缩小,对急性发作期的效果比慢性迁延期好。
临床上灵芝与一些会损害肝脏的药物合用,可避免或减轻药物所致的肝损伤,保护肝脏。
灵芝治疗慢性B型肝炎
胡娟(2003)等报告灵芝胶囊治疗慢性B型肝炎患者的疗效。治疗期间,除应用甘草酸二铵(甘利欣)、促肝细胞生长素、肝泰乐等药物之外,均不用其它抗病毒药及免疫调节药。
灵芝胶囊治疗组86例,口服灵芝胶囊(每粒含天然灵芝1.5g),每次2粒,一日三次;对照组50例,口服小柴胡汤冲剂,每次1包,一日三次。两组均用药一至两个月。
疗效指标:观察临床症状(病人的自觉症状)和体徵(医生检查病人时发现的异常现象),检测ALT、血清胆红素(SB)、HBsAg(阳性代表体内有B肝病毒存在,但无传染性;阴转表示已痊癒)、HBeAg(阳性表示体内B肝病毒繁殖快、数量多、感染力强;阴转表示病毒活动力减弱,进入肝炎缓解期)、B型肝炎病毒核心抗体(抗-HBc,阳性代表曾感染B肝病毒且有产生抗体)。
结果,两组的症状改善有显着差异(如下表),而且治疗组肝功能(ALT、SB)恢复正常百分率及HBsAg、HBeAg、抗-HBc阴转率,也都显着高於对照组【图3、图4】。综合所有实验数据显示,灵芝胶囊用於辅助治疗慢性B型肝炎有较好的疗效(4)。
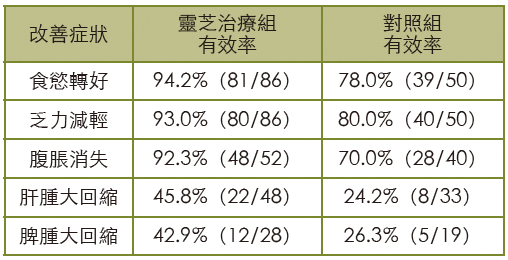
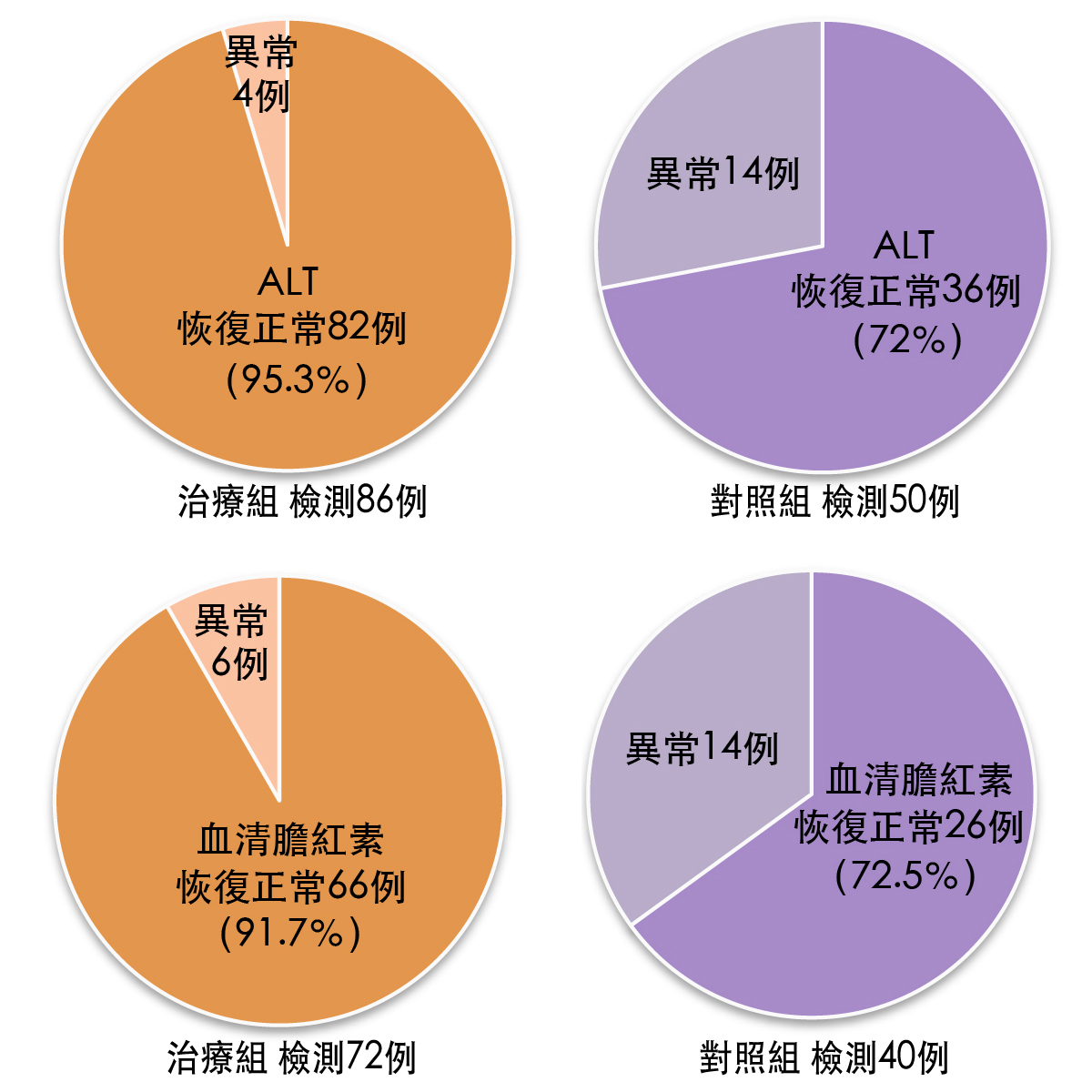
图3 治疗後肝功能恢复情况比较
注:两组ALT、SB恢复正常例数比较,P<0.05
(制图/吴亭瑶)
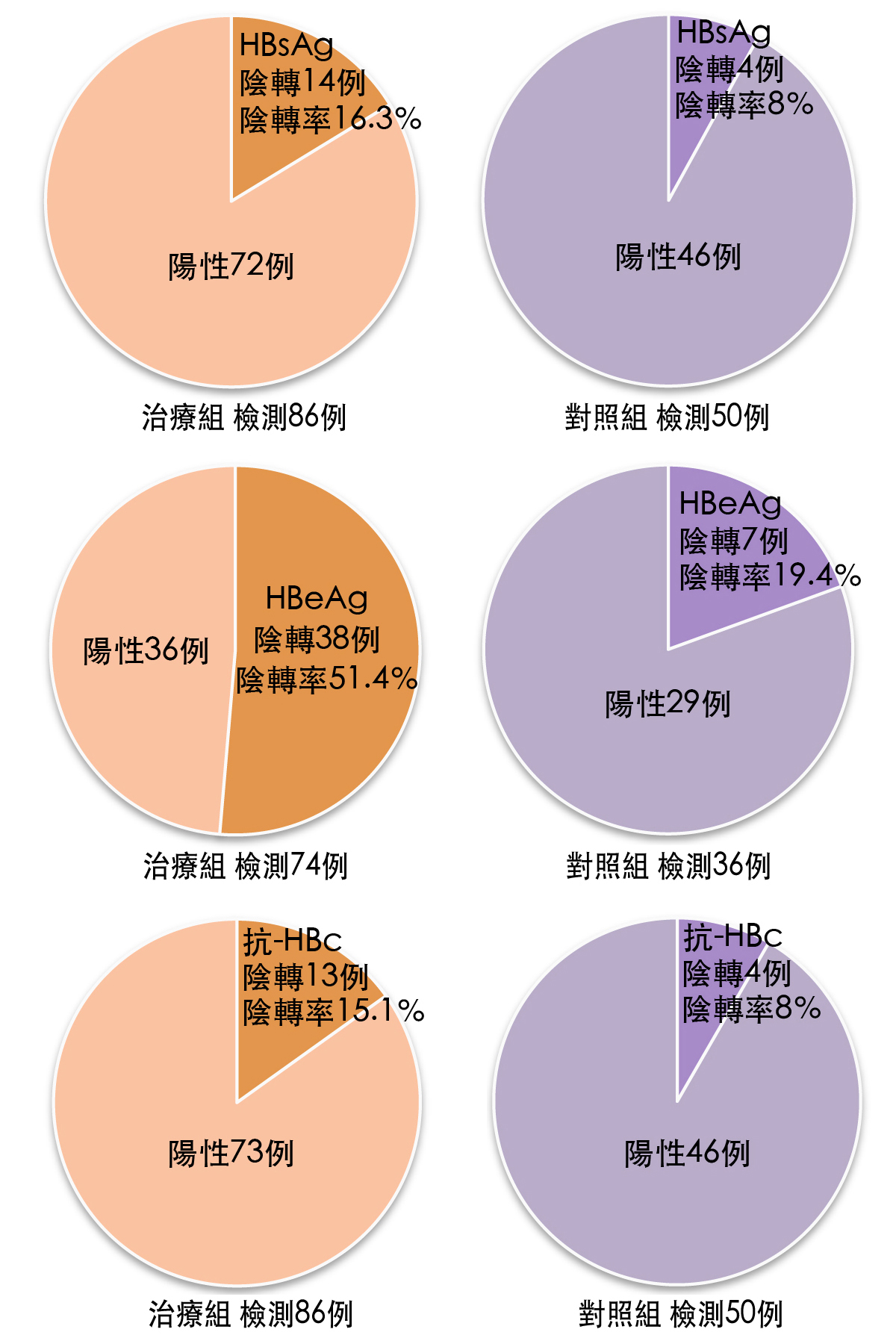
图4 治疗後两组B肝病毒标志物转阴情况比较
注:两组HBeAg转阴例率比较,P<0.05
(制图/吴亭瑶)
灵芝联合抗病毒药治疗慢性B型肝炎
钟建平等(2006)比较抗病毒药拉美芙锭Lamivudine(LAM)联合灵芝与单用LAM治疗慢性B型肝炎的疗效。两组患者的HBeAg、B型肝炎病毒相关DNA聚合酶(HBV-DNA)均为阳性,ALT较正常上限升高二至三倍、总胆红素(SB)小於三倍正常上限。
此实验受试者排除:(1) 重叠感染其它型病毒肝炎(HAV、HCV、HEV、HDV、HGV)者;(2) 自体免疫性肝病者;(3) 合并脂肪肝者;(4) 有糖尿病等并发症者。
按1:1比例随机将126例患者分为LAM组和联合组,每组63例,两组在年龄、性别、病程、口服一般保肝药及母亲HBVM阳性构成方面,均无统计性差异。LAM组每日口服LAM 100mg;联合组每日口服LAM 100mg并加灵芝50g、红枣10g。
治疗十八个月後,联合组ALT为63±17U,明显优於LAM组的83±21U(P<0.01);联合组总胆红素为21.5±8.3μmol/L,LAM组为25.9±10.3μmol/L,两组比较有显着差异(P<0.01)。
【表1】显示两组患者治疗後HBeAg阴转率及HBeAg/抗-HBe血清转换率的比较。治疗十八个月後,联合组HBeAg阴转率及HBeAg/抗-HBe血清转换率均高於LAM组(P<0.05);联合组63例中HBV-DNA阴转率在三、六、十二、十八个月时分别为50、56、59 、57例,LAM组63例中分别为43、50、48、42例,联合组均明显优於LAM组(均P<0.01)。
表1 治疗後两组患者HBeAg转阴率、HBeAg/HBeAb血清转换率比较
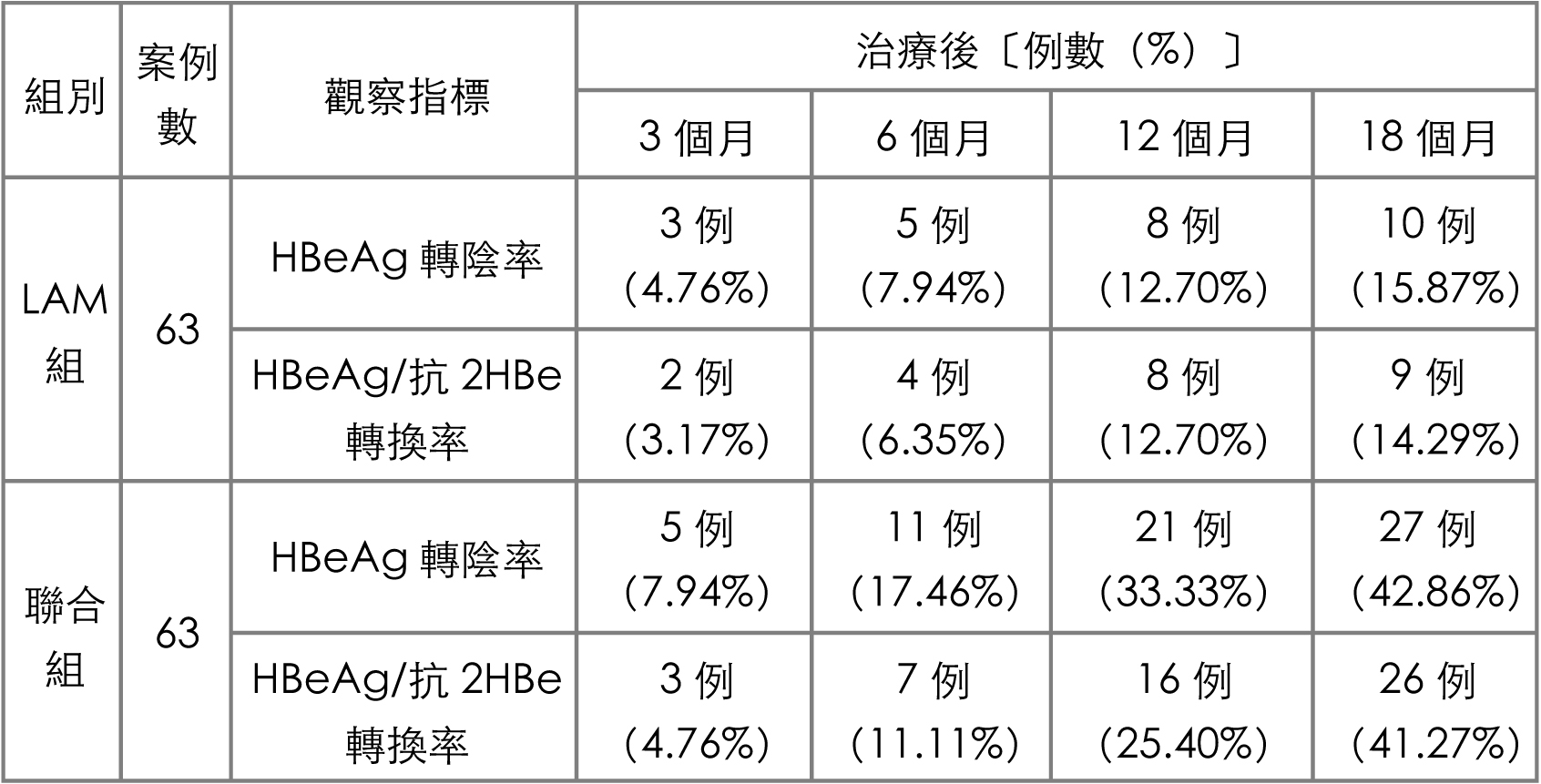
【注】LAM组每日口服抗病毒药拉美芙锭(LAM)100mg;
联合组63例,每日口服LAM 100mg并加灵芝50g、红枣10g
LAM组病毒DNA编码的DNA聚合酶基因序列YMDD变异发生率,在六、十二、十八个月时各为11.59%、23.81%、33.33%,联合组各为0、6.35%、9.52%,明显比单用LAM组低(均P<0.05)。
结果显示,灵芝联合LAM治疗慢性B型肝炎比单用LAM疗效好,且能延缓和减少在LAM治疗中易出现的YMDD变异,及因此产生的病毒株对LAM的耐药性,阻止B肝病毒复制,并有明显改善肝功能之作用(5)。
灵芝联合干扰素治疗慢性B型肝炎
钱小奇等(2005)观察,灵芝孢子油联合干扰素-A2b治疗慢性B型肝炎患者的疗效。81例患者HBV-DNA均为阳性,定量>1.0×105 copies/mL,均为HBsAg阳性、HBeAg阳性、抗-HBc阳性、血清ALT在正常参考值上限二至五倍,排除其它类型肝炎病毒重叠感染。
随机将患者分成治疗组和对照组,治疗组39例用干扰素-A2b联合灵芝孢子油胶囊治疗,干扰素-A2b 500万U/日,肌肉注射一个月,之後改为隔日1次,六个月为一个疗程;同时口服灵芝孢子油胶囊,1粒0.5g,一天两次,连服十二个月。对照组42例,只用干扰素-A2b,剂量、疗程同治疗组。治疗六、十二个月後,分别采用萤光定量PCR法检测患者HBV-DNA水准。
治疗六个月後,治疗组HBV-DNA阴转率80.05%(32/39),对照组HBV-DNA阴转率64.29%(27/42),两组比较无显着性差异(x2= 3.226,P>0.05)。治疗十二个月後,治疗组HBV-DNA阴转率79.48%(31/39),对照组HBV-DNA阴转率为38.10%(16/42),两组比较有显着性差异(x2= 9.790,P<0.01)。结果显示,干扰素-A2b联合灵芝孢子油胶囊可提高慢性B型肝炎患者HBV-DNA的阴转率,这可能与灵芝孢子油增强干扰素-A2b的免疫活性有关(6)。
灵芝的护肝作用的药理与临床研究,初步诠释了《神农本草经》论述灵芝「补肝气」、「益脾气」的实质内涵。
参考文献
1. 北京医学院学报,1974,(4):246-254.
2. 药学学报,2000,35(5):326-329;IJMM, 2002,4:337-342.
3. Biotechnol Lett, 2006, 28(11):837-841.
4. 职业与健康,2003,19(3):103-104.
5. 现代实用医学,2006,18(7):466-467.
6. 中医研究,2005,18(1):29-30.


