「肿瘤免疫逃逸」指的是肿瘤细胞可以避开免疫系统的监控、追缉和攻击,在体内快速增生。究其原因,除了患者免疫功能低下之外,也与肿瘤细胞很容易伪装、变造有关。而根据林志彬的研究团队证实,灵芝多醣Gl-PS不仅能让这些狡滑的肿瘤现形,还能让受到肿瘤抑制的免疫细胞恢复活性,此消彼长的结果,自然有助於免疫系统战胜肿瘤。
文/林志彬
◎本文原载於2014年《健康灵芝》第64期 6~8页&第65期 2~3页
肿瘤免疫逃逸(tumor escape)是指,受多种因素影响,使肿瘤细胞处於身体免疫监视的「死角」而逃避免疫系统的识别和攻击,得以在体内快速增殖的现象。造成肿瘤免疫逃逸的原因有二,其一是身体(宿主)的因素,亦即宿主免疫功能低下、免疫耐受、APC(抗原呈现细胞)呈现功能低下等,均不利於免疫系统杀伤肿瘤细胞,有助於肿瘤的免疫逃逸。另一原因则与肿瘤细胞本身有关,包括:
1. 肿瘤细胞表现抗原的缺失和调变:前者是指肿瘤细胞本身不表现「可诱发身体抗肿瘤免疫反应」的抗原性物质;後者则指受到免疫攻击後,肿瘤细胞表现的抗原减少或改变性质,以避免被免疫细胞杀伤。
2. 肿瘤细胞的漏逸:肿瘤细胞迅速生长,使身体的免疫系统不能有效且即时清除大量生长的肿瘤细胞。
3. MHC分子的表现下调或缺失:约有15%的肿瘤细胞会出现MHC(主要组织相容性复合体)突变或缺失,而低表现或不表现MHC分子。此类肿瘤细胞不表现MHC-Ⅰ或MHC-Ⅱ分子,使肿瘤细胞无法有效呈现肿瘤抗原,进而能逃避CTL(毒杀型T细胞)或CD4+ Th(第一型T辅助细胞)的识别。
4. 协同刺激因子的缺乏:肿瘤细胞低表现或不表现协同刺激因子,使T细胞的活化缺乏第二激活信号因子。
5. 分泌免疫抑制因子:肿瘤细胞分泌TGF-β(转化型生长因子-β)和IL-10(白介质-10)等抑制因子,抑制身体的抗肿瘤免疫应答。
6. 肿瘤细胞的「蒙面术」:一些肿瘤细胞会合成大量糖萼(glycocalyx,富含唾液酸的黏脂多醣蛋白复合物)把自己包被起来,使抗体、补体及T细胞很难对其进行识别。
灵芝多醣促进黑色素瘤细胞MHC-Ⅰ分子及协同刺激因子的表现
肿瘤抗原肽与肿瘤细胞表面的MHC-Ⅰ分子结合形成复合物,再与T细胞表面的抗原受体结合,才能活化T细胞,并杀伤肿瘤细胞,这一过程还需要B7-1、B7-2等协同刺激因子与T细胞表面的CD28分子结合。而恶性肿瘤细胞常表现为MHC-Ⅰ分子和协同刺激因子的低表现或不表现,这是构成肿瘤免疫逃逸的机制之一。
近年来,我们团队的李卫东副教授、孙立新博士针对「 灵芝多醣(Gl-PS)促进B16F10黑色素瘤细胞MHC-Ⅰ分子和协同刺激因子的表现」进行探讨:
B16F10黑色素瘤细胞不表现MHC-Ⅰ、B7-1、B7-2等分子,或表现不足,但RT-PCR检测结果却显示,与RPMI 1640培养基对照组相比,不同浓度Gl-PS(200、400、600μg/ml)作用四十八小时,能使B16F10黑色素瘤细胞MHC-Ⅰ分子、H-2Kb和H-2Db mRNA表现增加,也能使B7-1和B7-2 mRNA表现增加【图1】。
以流式细胞仪检测的结果也显示,Gl-PS可使H-2Kb、H-2Db、B7-1和B7-2分子表现增强。此外,Gl-PS作用的B16F10黑色素瘤细胞,与PHA活化的小鼠脾淋巴细胞共同培养,淋巴细胞介导的抗B16F10细胞毒活性,较对照组明显提高 (1、2)。
综合以上结果可知,Gl-PS有促进黑色素瘤细胞MHC-Ⅰ分子和协同刺激因子表现的作用。
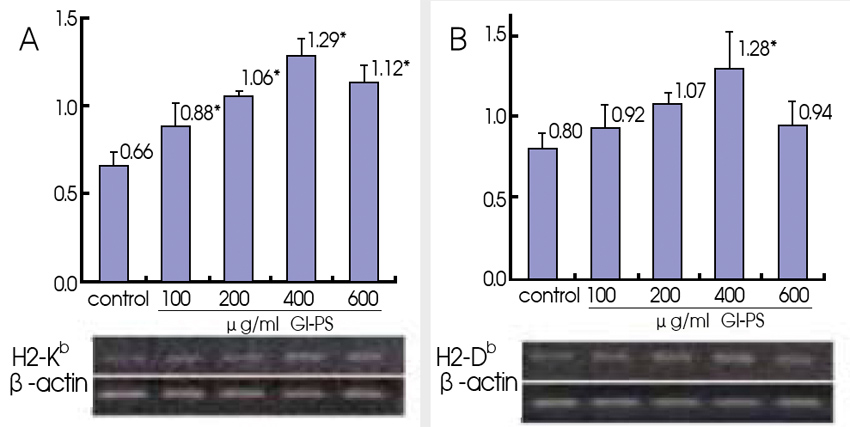
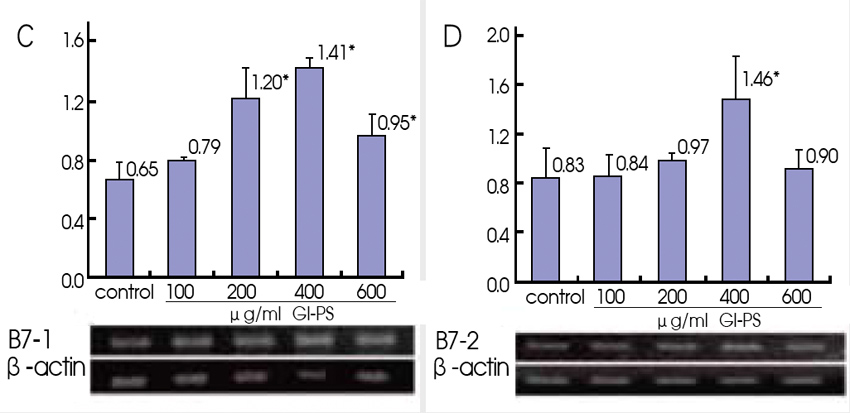
图1 Gl-PS对B16F10黑色素瘤细胞
H-2Kb、H-2Db、B7-1和B7-2 mRNA表现的影响
n=4,Mean±SD,*P<0.05与对照组比较。(图片提供/林志彬)
灵芝多醣抑制黑色素瘤细胞分泌免疫抑制因子
肿瘤细胞可产生多种免疫抑制因子,抑制免疫细胞的功能,逃避身体免疫系统的攻击。IL-10、TGF-β、VEGF(血管内皮生长因子)是肿瘤细胞中常见的免疫抑制因子,经ELISA方法检测,B16F10黑色素瘤细胞培养上清液中IL-10、TGF-β、VEGF浓度,显着高於RPMI 1640培养基对照组,说明B16F10黑色素瘤细胞可分泌这三种细胞因子。
在PHA诱导的小鼠脾淋巴细胞增殖反应试验,加入B16F10黑色素瘤细胞培养上清液,可显着抑制淋巴细胞增殖反应,但如果同时加入Gl-PS(0.2~12.8μg/ml),则可使受抑制的「淋巴细胞增殖活性、穿孔素表现、混合淋巴细胞反应」显着增强,同时Gl-PS(3.2μg/m、12.8μg/ml)还能使受抑制的颗粒酶B表现增加。
结果表明,灵芝多醣可在一定程度拮抗B16F10黑色素瘤细胞培养上清液诱导的免疫抑制,这可能与灵芝多醣抑制B16F10黑色素瘤细胞分泌免疫抑制因子有关。
进一步研究发现,Realtime RT-PCR检测结果显示,Gl-PS可使B16F10黑色素瘤细胞的IL-10 mRNA、TGF-β1 mRNA、VEGF mRNA表现显着降低【图2】;ELISA检测结果也显示,Gl-PS可使B16F10黑色素瘤细胞培养上清液生成IL-10、TGF-β1和VEGF的浓度显着减少【图3】(3)。综合以上结果可知,灵芝多醣确实有抑制肿瘤细胞分泌免疫抑制因子的能力。
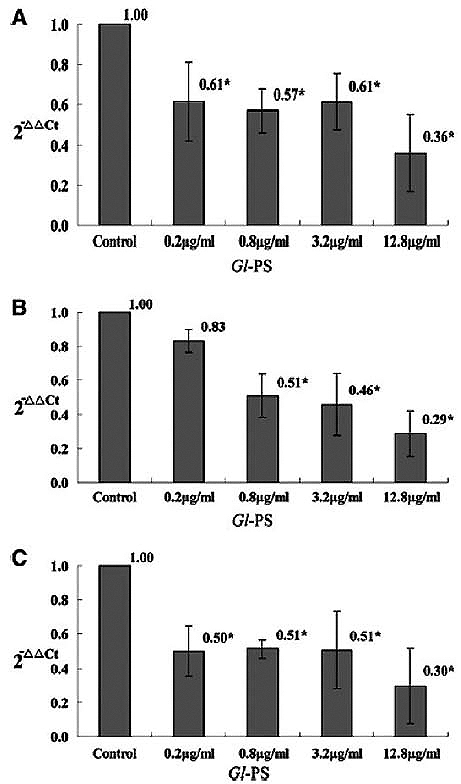
图2 Gl-PS对B16F10黑色素瘤细胞
TGF-β1、IL-10和VEGF mRNA表现的影响
n=3,Mean±SD,*P<0.05与对照组比较。(图片提供/林志彬)
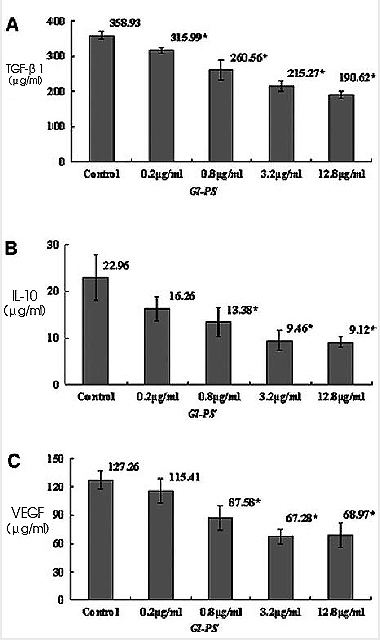
图3 Gl-PS对B16F10黑色素瘤细胞的培养上清液中
TGF-β1、IL-10和VEGF浓度的影响
n=4,Mean±SD,*P<0.05与对照组比较。(图片提供/林志彬)
灵芝多醣拮抗黑色素瘤细胞培养上清液抑制巨噬细胞功能
李卫东、孙立新等的研究还发现,B16F10黑色素瘤细胞培养上清液,对巨噬细胞的抗肿瘤活性亦有抑制作用。在用LPS活化巨噬细胞时,加入B16F10黑色素瘤细胞培养上清液,可抑制巨噬细胞的活化,但如果同时加入不同剂量的灵芝多醣(Gl-PS),则可拮抗这种抑制作用。
与未加灵芝多醣的对照组相比,Gl-PS(0.2~12.8μg/mL)可使受抑制的巨噬细胞吞噬活性增强,Gl-PS(12.8μg/mL)可使受抑制的巨噬细胞生成较多的TNF-α(肿瘤坏死因子-α),对於受抑制的TNF-α杀伤L929肿瘤细胞之活性,Gl-PS(0.2~12.8μg/mL)也有增强的作用(图4~6)〔4〕。
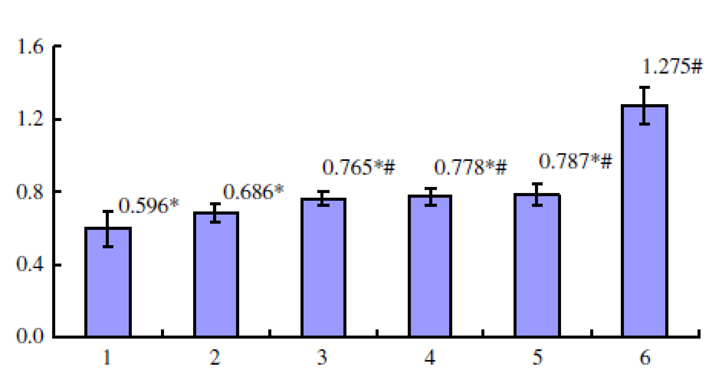
图4 Gl-PS拮抗黑色素瘤细胞培养上清液抑制
LPS活化的巨噬细胞吞噬功能
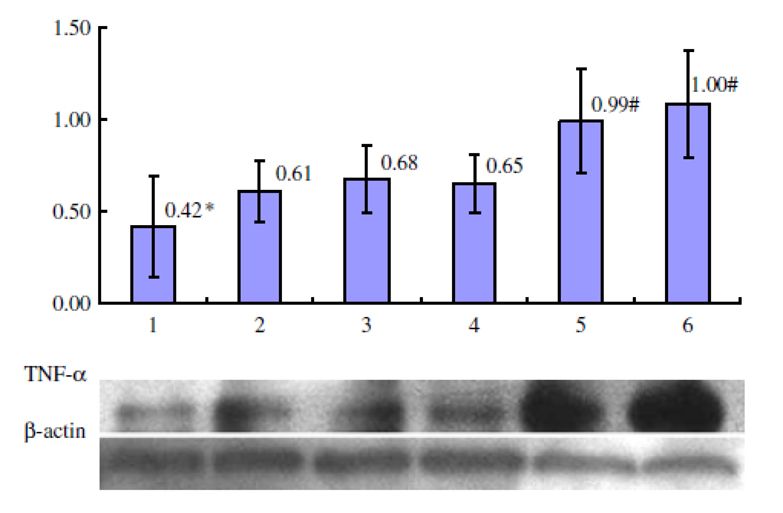
图5 Gl-PS拮抗黑色素瘤细胞培养上清液抑制
LPS活化的巨噬细胞TNF-α产生
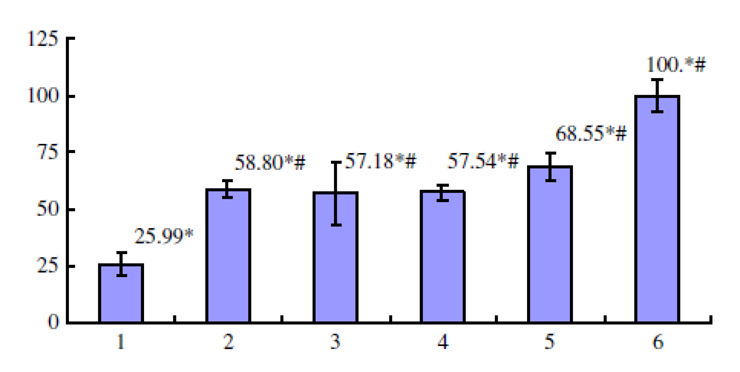
图6 Gl-PS拮抗黑色素瘤细胞培养上清液抑制
LPS活化巨噬细胞分泌的TNF-α杀伤L929肿瘤细胞之活性
【图4~6说明】第1组为「黑色素瘤细胞培养上清液对照」;
第2~5组各为黑色素瘤细胞上清液+Gl-PS 0.2 μg/mL(2组)、0.8 μg/mL(3组)、3.2 μg/mL(4组)、12.8 μg/mL(5组);
第6组为「无黑色素瘤细胞培养上清液,且无Gl-PS对照」。
*P<0.05,与第6组比较;#P<0.05,与第1组比较。(图片提供/林志彬)
灵芝多醣拮抗肺癌患者血浆诱导的淋巴细胞活性抑制作用
为了让研究结果更接近临床实践,李卫东、孙立新等与临床医生合作,取得尚未做任何常规肿瘤治疗的12例肺癌患者的血浆,观察肺癌患者血浆对正常人外周血淋巴细胞活性的抑制作用,以及灵芝多醣的干预作用。
将不同浓度的灵芝多醣加入受肺癌患者血浆抑制的正常人外周血淋巴细胞,再用PHA活化淋巴细胞,结果发现,与未加灵芝多醣的对照组相比,Gl-PS(3.2、12.8 μg/mL)可显着增强受抑制的淋巴细胞表面抗原CD69的表现(图7),Gl-PS(0.2~12.8 μg/mL)可显着改善受抑制的淋巴细胞增殖活性(图8),Gl-PS(0.2~12.8 μg/mL)可明显提高受抑制的淋巴细胞穿孔素(perforin)和颗粒酶B之表现(图9、10)。後两者均为T淋巴细胞产生的杀伤肿瘤细胞之活性成分〔5〕。
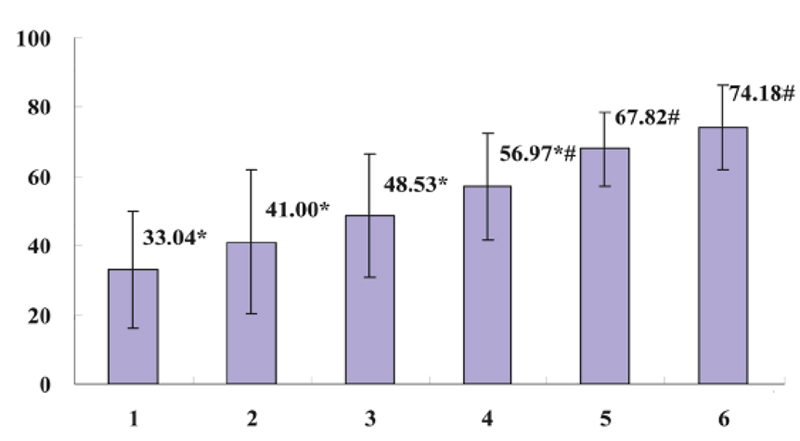
图7 肺癌患者血浆抑制PHA诱导的单核淋巴细胞CD69表现
及Gl-PS对其之拮抗作用
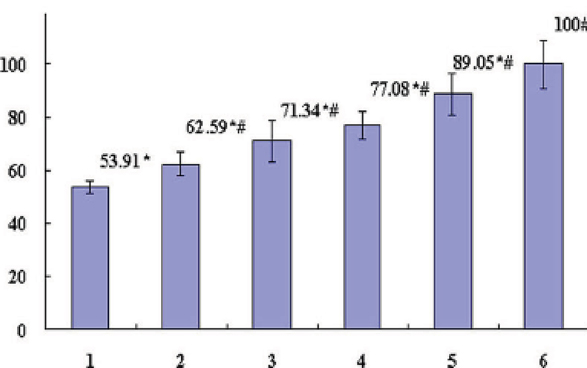
图8 肺癌患者血浆抑制PHA诱导的单核淋巴细胞增殖
及Gl-PS对其之拮抗作用
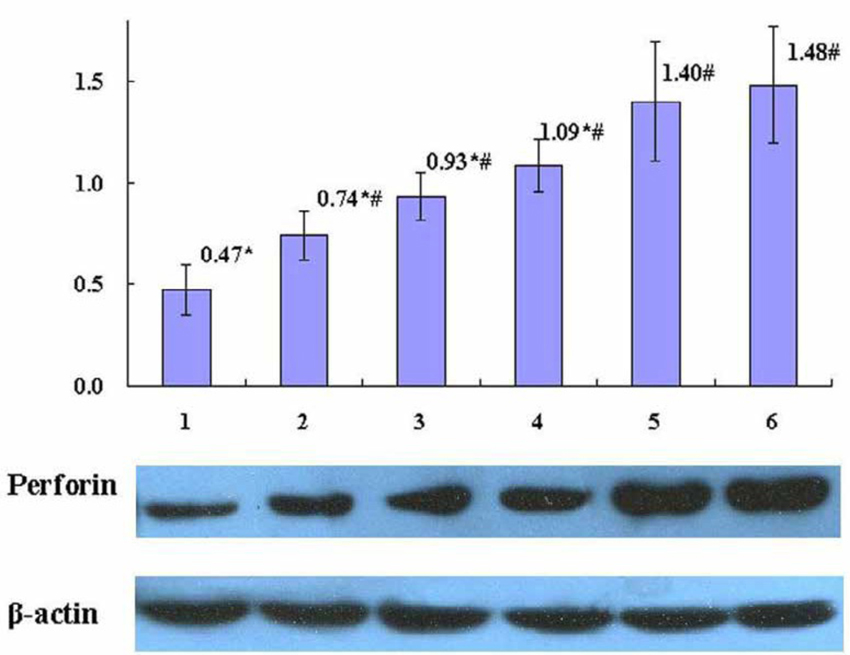
图9 Western blot检测肺癌患者血浆抑制PHA诱导的perforin表现
及Gl-PS对其之拮抗作用
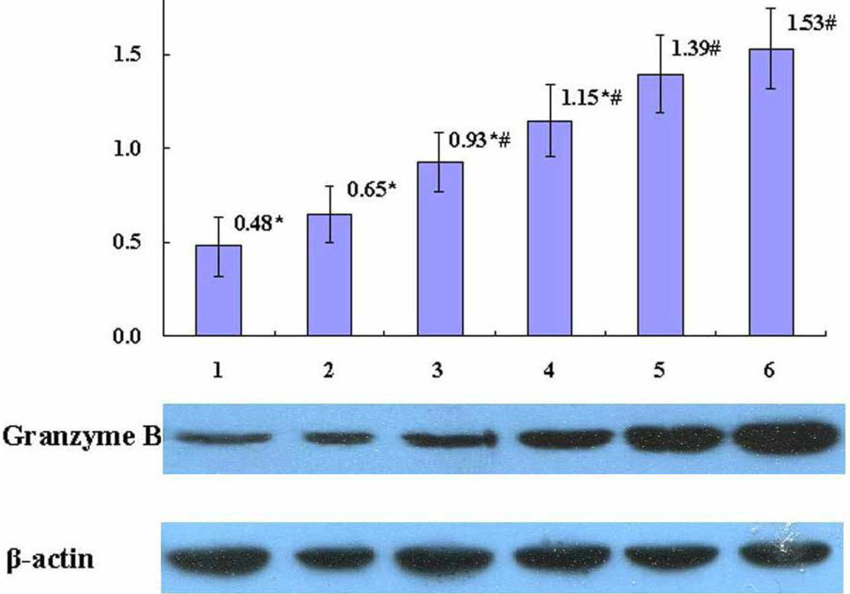
图10 Western blot检测肺癌患者血浆抑制PHA诱导的颗粒酶表现
及Gl-PS对其之拮抗作用
【图7~10说明】第1组为「肺癌病人血浆对照」;
第2~5组各为肺癌病人血浆+Gl-PS 0.2μg/mL(2组)、0.8μg/mL(3组)、3.2μg/mL(4组)、12.8μg/mL(5组);
第6组为「健康人血浆对照」。*P<0.05,与第6组比较;
#P<0.05,与第1组比较。(图片提供/林志彬)
结论
以上研究结果表明,灵芝多醣可以透过「促进黑色素瘤细胞MHC-1分子和协同刺激因子B7-1与B7-2的表现」,以及「抑制黑色素瘤细胞分泌免疫抑制因子IL-10、TGF-β、VEGF」,进而增强淋巴细胞与巨噬细胞杀伤肿瘤细胞的活性,使黑色素瘤无法逃脱免疫系统的攻击。灵芝多醣拮抗肺癌患者血浆诱导的淋巴细胞活性抑制作用,更扩大了灵芝多醣抑制肿瘤免疫逃逸的应用范围。
【参考文献】
1. Sun LX , et al . Enhanced MHC class I and costimulatory molecules on B16F10 cells by Ganoderma lucidum polysaccharides. J Drug Target. 2012 Aug; 20(7) : 582-92.
2. Sun LX, et al. Promoting effects of Ganoderma lucidum polysaccharides on B16F10 cells to activate lymphocytes. Basic Clin Pharmacol Toxicol. 2011 Mar; 108(3) : 149-54.
3. Sun LX, et al. Suppression of the production of transforming growth factor β1, interleukin-10, and vascular endothelial growth factor in the B16F10 cells by Ganoderma lucidum polysaccharides. J Interferon Cytokine Res. 2014 Sep; 34(9) : 667-75.
4. Lu J, et al. Antagonism by Ganoderma lucidum polysaccharides against the suppression by culture supernatants of B16F10 melanoma cells on macrophage. Phytother Res. 2014 Feb; 28(2): 200-6.
5. Sun LX, et al. Protection against lung cancer patient plasma-induced lymphocyte suppression by Ganoderma lucidum polysaccharides. Cell Physiol Biochem. 2014; 33(2): 289-99.


