有「肿瘤抑制蛋白」之称的p53是抑制癌细胞增生的重要推手,有些癌症患者的p53基因虽然正常的,但它所合成的p53蛋白却没有足够的量和活性,以致指挥不太动它的「手下」送出停止细胞生长的指令,所以肿瘤才会长个不停。这样的癌症治疗起来是很棘手的,尤其是对於原本就不好治疗的肺癌患者来说。如何对症下药解决这个问题?阳明大学许先业教授、陈一村副教授等发表在《Carcinogenesis》的研究成果已经为我们找到了答案。
文/吴亭瑶

来自灵芝(Ganoderma lucidum)菌丝体的免疫调节蛋白LZ-8不只有调节免疫细胞的功能,还能直接与难搞的肺癌细胞对战。
根据阳明大学医技系许先业教授、陈一村副教授共同主持的研究显示,LZ-8可活化肺腺癌细胞里肿瘤抑制蛋白p53的表现,提升p53的活性,进而降低肺癌细胞的增生速度,并且抑制肺癌肿瘤的生长。此研究成果已於2011年发表在英国牛津大学出版的医学期刊《Carcinogenesis》(致癌作用)。
灵芝蛋白对肺腺癌细胞增生的抑制作用
研究团队使用的灵芝免疫调节蛋白LZ-8,是以面包酵母菌(Saccharomyces cerevisiae)为载体进行大量生产的灵芝蛋白rLZ-8,其胺基酸组成结构和免疫活性皆与天然的LZ-8相同。
细胞实验显示,不论人类肺腺癌细胞株A549或小鼠肺腺癌细胞株LLC1,在加入rLZ-8一起培养之後,癌细胞增生的速度明显比没有rLZ-8减缓许多,说明rLZ-8对癌细胞的生长有抑制作用,而且抑制效果与rLZ-8的剂量呈正相关(图1)。
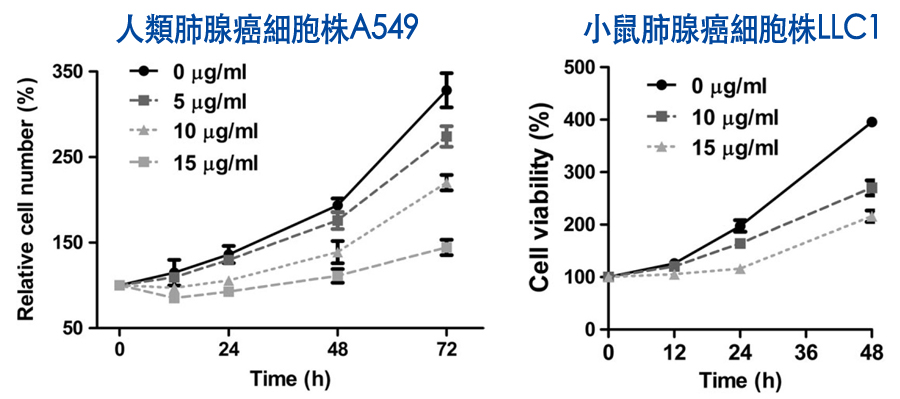
图1 灵芝蛋白rLZ-8对肺腺癌细胞增生的抑制作用
灵芝蛋白对肺腺癌肿瘤的抑制作用
进一步透过动物实验观察rLZ-8在体内的肿瘤抑制作用:先给小鼠植入肺腺癌细胞株LLC1,四天後再开始以腹腔注射的方式给予rLZ-8,每隔四天注射一次,每次剂量4 mg/kg或12 mg/kg。另设有控制组小鼠未予治疗、给予PBS(磷酸盐缓冲生理盐水),以与前面两组对照。
结果发现,三组小鼠的体重变化几乎没什麽差异(图2),但长出来的肺癌肿瘤体积却有相当大的差距──当控制组小鼠的肿瘤长超过2000 mm3的时候,低剂量rLZ-8组大约只有它的三分之一,高剂量rLZ-8更只有它的六分之一左右(图3)。
这说明rLZ-8可以在体内发挥抑制肺癌肿瘤的作用,并且维持比较好的体重──体重相当,肿瘤愈小,代表身体愈有肉──这除了证明rLZ-8的安全性,也说明rLZ-8可以提升肿瘤小鼠对抗肺腺癌的身体能量。
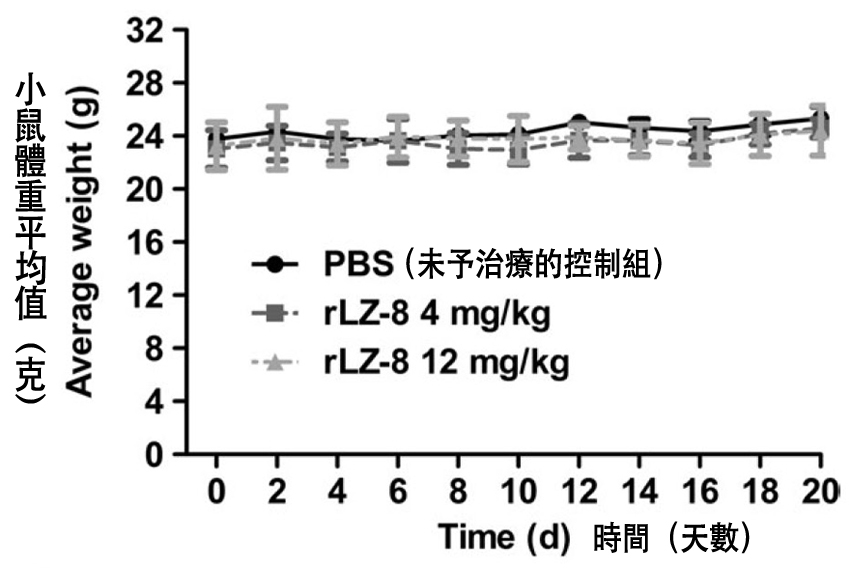
图2 灵芝蛋白rLZ-8对肺腺癌小鼠的体重影响
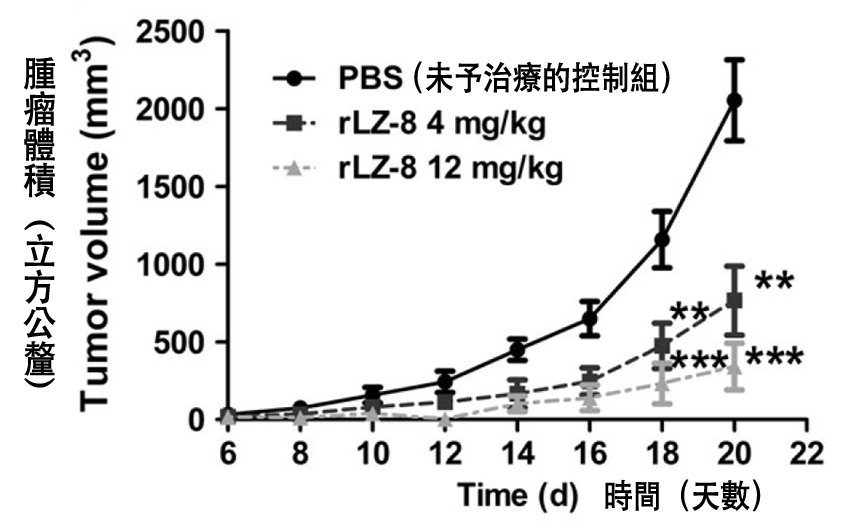
图3 灵芝蛋白rLZ-8对肺腺癌小鼠的肿瘤生长抑制作用
灵芝蛋白抑制肺腺癌的作用机制
rLZ-8之所以能抑制肺癌细胞增生和肿瘤生长,与癌细胞内的「肿瘤抑制蛋白p53」有关。
每个人身上的细胞里都有p53基因和由这个基因合成的p53蛋白。对正常细胞来说,p53就像DNA品质监控者,一旦发现缺损就会命令细胞修复,若修复无望,就会命令细胞停止生长(不再进行细胞分裂),并启动细胞凋亡机制,以免这异常的细胞变成癌细胞。
所以p53是抑制癌细胞生长的重要推手,有些癌症患者因为p53基因突变或缺损而导致癌细胞生长失控,但有些癌症患者的p53基因却是正常的,问题出在它所合成的p53蛋白没有足够的量和活性,以致指挥不太动它的手下(如p21、p27)送出停止细胞分裂的指令。
造成p53蛋白「失活」的关键因素和一种称为MDM2的蛋白有关,它会与p53结合,使p53失去活化下游蛋白的能力,还会让p53被细胞内的酵素分解掉。不过MDM2也有「克星」,当它与核醣体蛋白(如S7)结合後,就失去干扰p53的能力。再者,p53一旦活化後就会变得极为稳定,而不会再受MDM2影响。
本实验使用的肺腺癌细胞,就是属於有p53基因(wild-type p53),但53蛋白失去活性或表现量不足的状况。根据许先业、陈一村等的细胞分子研究显示,rLZ-8可以促进核醣体蛋白S7的释出,促进S7与MDM2的结合,并且提高p53蛋白的活性和表现量。
进一步检测肺癌小鼠身上的肿瘤组织也可发现,有rLZ-8治疗者,p53蛋白及其下游蛋白p21、p27等的表现量都明显增加(图4)。这说明rLZ-8确实能帮助p53蛋白重拾雄风,促使癌细胞一分为二、二分为四……的增生大业划下休止符,进而抑制肿瘤的生长。
据了解,约有一半的肺癌患者属於「具有p53基因,但p53蛋白无法发挥功能」的类型,未来是否有机会将灵芝免疫调节蛋白应用在这类肺癌患者身上,令人引颈期盼。
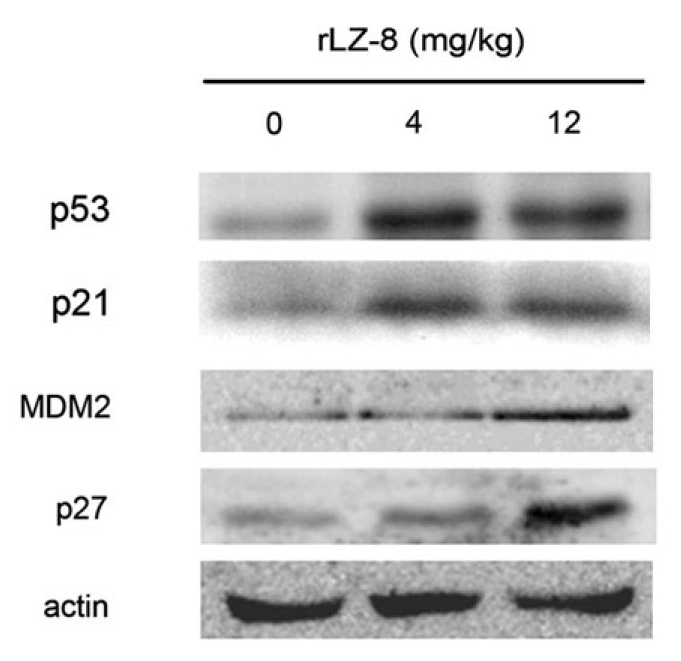
图4 灵芝蛋白rLZ-8对肺腺癌小鼠肿瘤组织中p53蛋白及相关蛋白的表现量
〔资料来源〕Wu CT, et al. Ling Zhi-8 Mediates p53-dependent Growth Arrest of Lung Cancer Cells Proliferation via the Ribosomal Protein S7-MDM2-p53 Pathway. Carcinogenesis. 2011 Dec;32(12):1890-6. doi: 10.1093/carcin/bgr221. Epub 2011 Oct 7.


