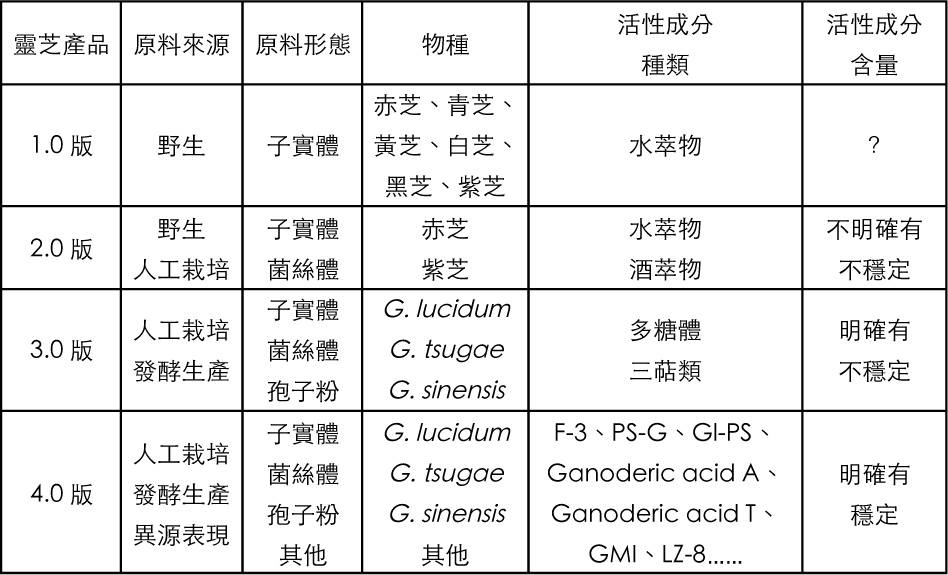
专研灵芝三十多年的台大教授许瑞祥,把灵芝产品和产业的演变,根据「吃出有效」的可靠性,分为1.0、2.0、3.0、4.0四个等级和阶段,其所代表的是,灵芝自古至今被人们应用,在种源、生产、成分、功效等各层面,从「模糊不定」进步到「清楚稳定」的里程碑。产业和产品是相对应的。继〔上篇〕介绍灵芝1.0~3.0产业和产品的特色之後,接下来的〔中篇〕将介绍以多糖与三萜为活性成分指标的灵芝4.0。你吃的灵芝是属於4.0世代的吗?
文.图/许瑞祥(国立台湾大学生化科技学系兼任教授)
灵芝产业4.0── 一定有效
成分决定功效。灵芝从第一个活性成分被发现後历经三十年的探索,科学界从2000年开始,陆续发表有关灵芝高度纯化成分的作用机制,用细胞或分子模式研究其作用的靶点与讯息传递途径,精细描绘活性分子在癌化细胞内开启或关闭各种导致细胞凋亡或自噬的结果,为灵芝抗癌作用提供坚实的理论基础,让灵芝能抗癌不再只是期待的愿望,也为4.0版的灵芝产品和产业奠下基础。
一、多糖体
(一) 发现具抗肿瘤活性之灵芝多糖
多糖体是大家最熟悉的灵芝活性成分。1971年Sasaki等从野生树舌灵芝(G. applanatum)子实体中萃取具有抗肉瘤(S-180)细胞增生的活性成分,认为其活性来源是具有β(1→3)键结主链的葡萄糖聚合物,开启了灵芝多糖体的研究。
(二) 确认灵芝活性多糖的基本结构
1981年Usui等人发表从树舌灵芝分离出两种具有抗肿瘤活性的多糖体,皆为热水可溶的β-D-glucan──具有β(1→3)键结主链与β(1→6)键结分支的葡聚糖──此β-D-glucan即为大家最熟悉的高分子多糖体活性构形的基本组成。
1984年水野卓发表灵芝(G. lucidum)子实体经热水萃取、酒精沉淀、管柱层析後部分纯化的活性多糖体,其中分子量1,050,000的β-D-glucan是「以β(1→3)键结为主链,含有分歧频度4的β(1→6)键结,由六个糖连结的短支键构造」的抗肿瘤活性多糖体。
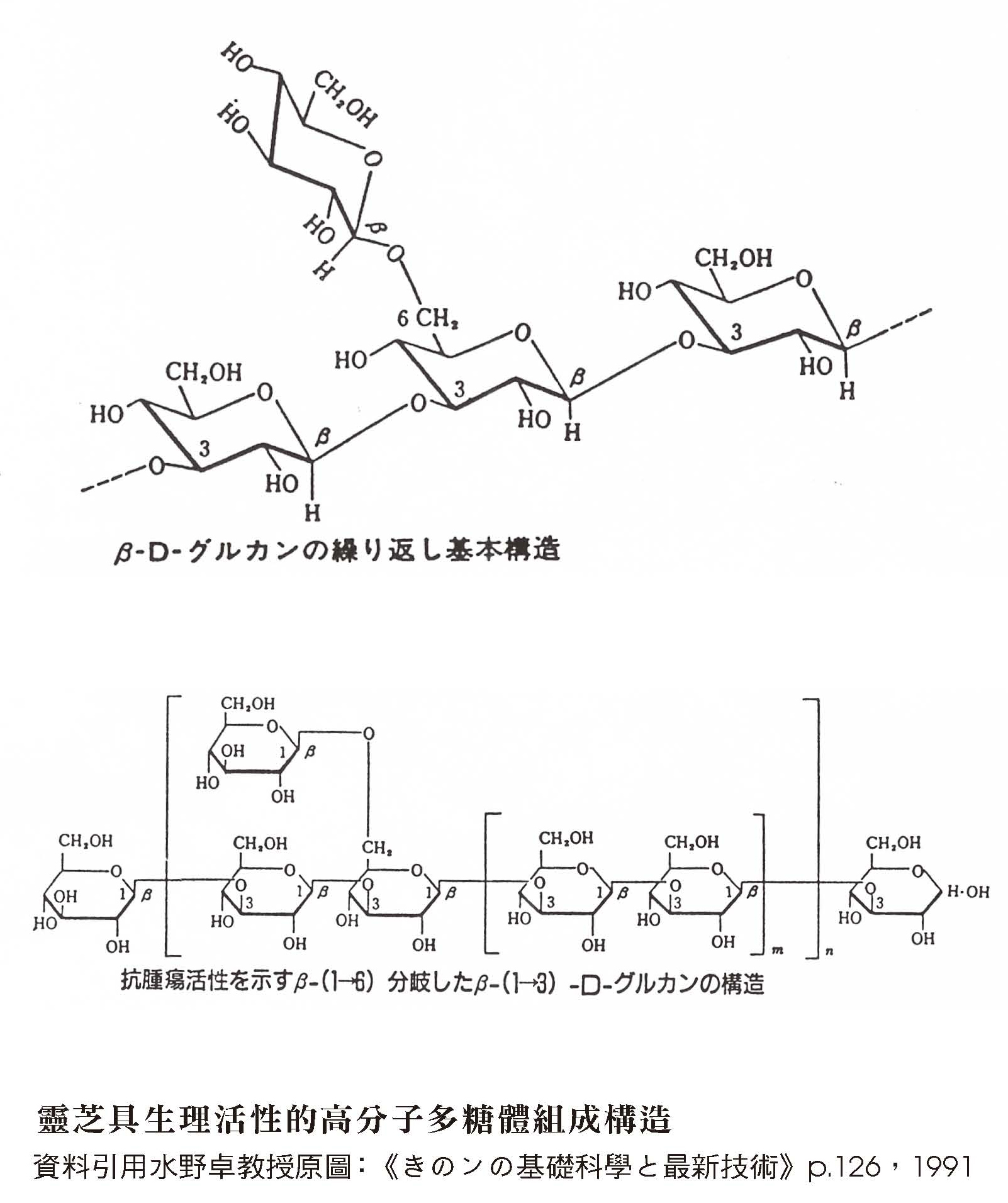
(三) 确认多糖构形会影响抗肿瘤活性;即使是同菌种,子实体与菌丝体的多糖构形并不相同
1985年Sone等人发表的报告,对灵芝子实体和菌丝体中经热水或稀硷溶液萃取而得的各种多糖体抗肿瘤活性进行比较。作者强调抗肿瘤活性强弱与其多糖体侧链分支的频度有关,被降低分支侧链的多糖体,其抗肿瘤活性相对降低。本篇论文亦为比较子实体和菌丝体来源多糖体组成构形差异与抗肿瘤作用关系的代表作。
此时期所发表多糖的分离纯化与组成分析技术日趋完整,对於抗肿瘤试验的多糖体分子量大小、键结方式与组成构形差异已有较精确的描述。
(四) 不同萃取方法、不同菌种来源,其多糖组成有差异性,此差异会影响抗肿瘤活性
1993年Wang等发表以松杉灵芝(G. tsugae)子实体来源的多糖体,经系列的分离与纯化後进行抗肿瘤活性评估,在其所得的十四种水溶性多糖与十五种水不溶性多糖中,发现只有七种具有抗肿瘤(S-180)活性,皆由β(1→3)-D-glucan为主链,并且含有部分蛋白质的糖蛋白聚合物。
作者同时亦比较三种具有抗肿瘤活性的灵芝、树舌灵芝、松杉灵芝间的多糖体组成与抗S-180肉瘤活性的评估。本研究使用三个物种为探讨对象,彰显不同物种间多糖组成的歧异,同时亦可了解在众多多糖构形间,抗肿瘤活性会有极大的落差,更明确的界定何谓活性多糖。
在不同材料的研究报告间,所谓多糖体的含量、组成与效果,是无法互相推论或引用的,因此不同原料基础所生产的灵芝产品功效自然也不能互相类比。
虽然已知灵芝活性多糖体是其抗肿瘤的重要有效成分,对於试验动物的移植性肿瘤具有生长抑制作用,并可使肿瘤的重量减轻,延长寄主动物生存的时间,但在活体内使用的多糖体,是直接杀死癌细胞,还是经由激发寄主体内抗肿瘤机制间接杀死癌细胞,此时尚无定论。
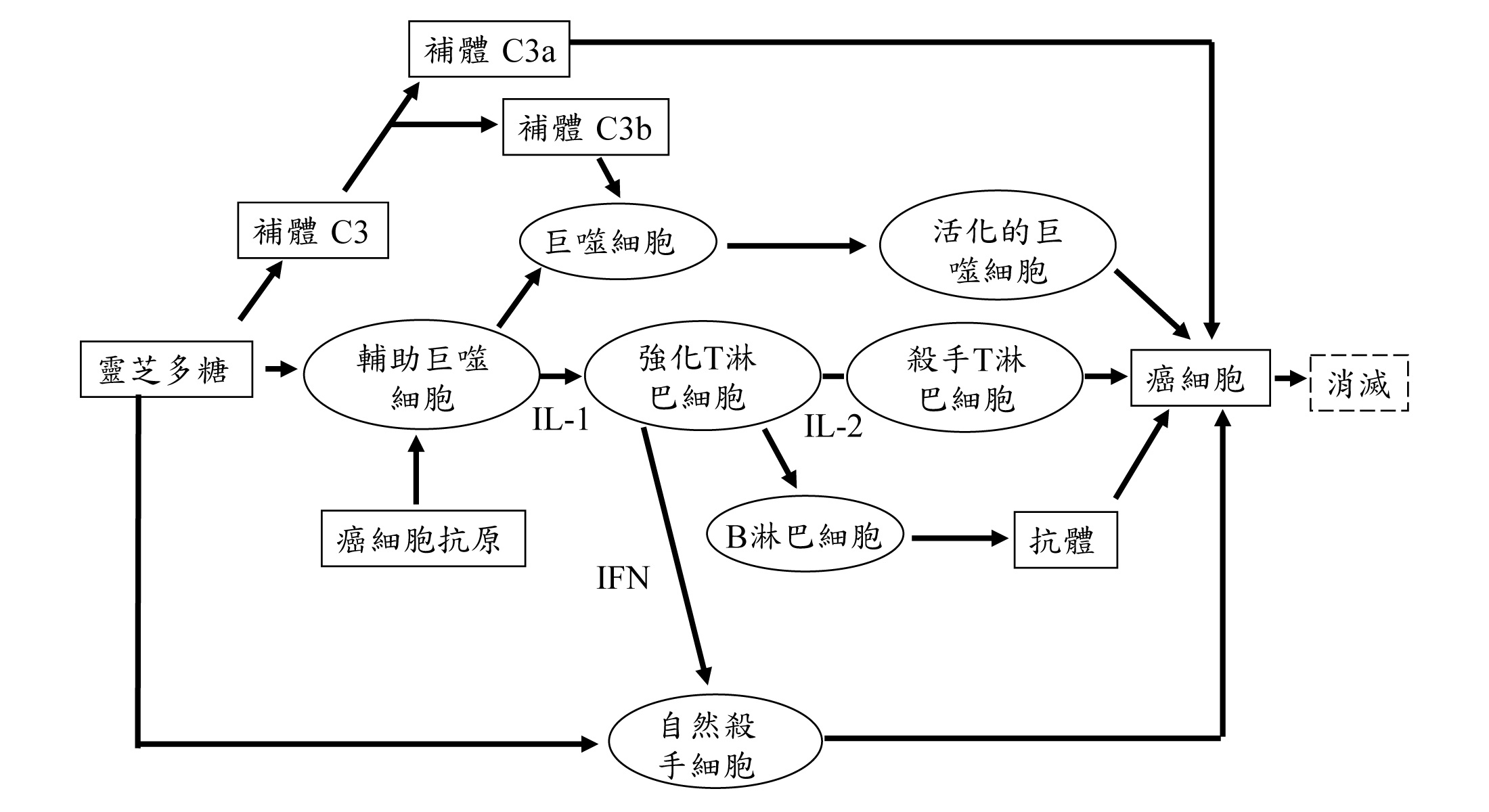
(五) 灵芝活性多糖-免疫细胞-抗肿瘤
1997年王声远等发表灵芝多糖能抑制肿瘤细胞的增殖作用,是透过免疫系统中巨噬细胞和T淋巴细胞产生的TNF-α和IFN-γ协同作用的结果。
灵芝与免疫的研究成果有了连接之後,灵芝多糖体抗肿瘤的机制才被确认,灵芝与免疫系统研究的精彩序幕也随之开启,灵芝研究的模式亦从动物推展至细胞株,从肿瘤细胞推展至免疫细胞,从体内推展到体外。
(六) 灵芝多糖F3与免疫细胞的分子机制
2002年翁启惠主导有关灵芝多糖体的系列研究,分析灵芝(G. lucidum)子实体经硷萃取酸中和乙醇沉淀的水溶性粗萃取物,发现其碳水化合物组成以葡萄糖(58%)和甘露糖(15.5%)为主,并含有岩藻糖(9.7%)、半乳糖(9.3%)和木糖(5.4%)等醣类,同时该粗萃取物中亦含有约15.6%的蛋白质。
此粗萃取物经胶体滤管柱层析後,回收得到五个主要含醣的部分。以小鼠脾细胞增生试验评估其主要活性表现的第三部分(F3),证明F3除了能促进脾细胞的增生外,亦可增加IL-1、IL-2和INF-γ的表现,并指出此高活性的F3组成是含有岩藻糖的醣蛋白。灵芝研究自此从基因体学进入蛋白质体学的领域,对於活性多糖体的组成与构形具备更精确的描述能力,成分精制的F3灵芝产品於是诞生。
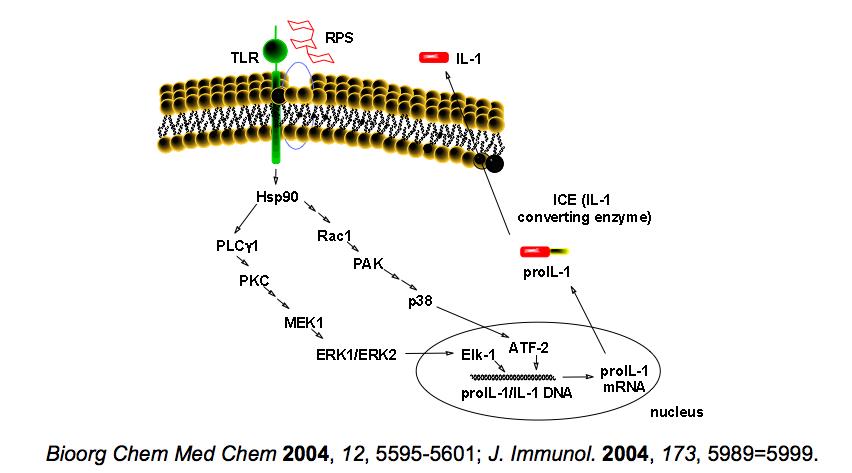
在许先业等所发表的论文中证实,F3是经由与巨噬细胞表面TLR4受体的结合来启动细胞内IL-1基因的表现。该研究对於IL-1基因於表现前的转录,F3调控後转录的pro-IL-1,以及IL-1的生成与分泌至胞外的过程,皆有清楚的了解,让我们对於灵芝多糖体在细胞外如何经由特定TLR4受体来启动胞内的基因表现,进而生成细胞激素後分泌到胞外参与免疫调节的过程,有更精确的认识。
(七) 灵芝多糖PS-G与免疫细胞的分子机制
大约在同时期,另一组团队亦发表由灵芝(G. lucidum)子实体经热水萃取、酒精沉淀的粗多糖,经过胶体管柱层析与阴离子交换树脂管柱分离纯化所得的高分子多糖体,代号为PS-G,此 PS-G是由95%的多糖体和5%的胜肽组成的多糖肽。
2005年Lin等证实PS-G亦是经由树突细胞表面的TLR-4受体将讯息传入细胞内,能促进树突细胞的成熟,进而合成并分泌细胞激素IL-12。IL-12能增强自然杀细胞和T细胞的噬菌能力,促使自然杀手细胞分泌INF-γ,还能诱导T细胞朝向第一型免疫反应分化,多糖体可经由细胞表面特定受体来启动、调节免疫功能,再度获得证实。
(八) 灵芝多糖Gl-PS与免疫细胞的分子机制
林志彬的研究团队发表灵芝(G. lucidum)子实体经热水提取、酒精沉淀、透析与去蛋白质等程序後所得多糖体,代号Gl-PS,此多糖经组成分析後,确认也是多糖肽,分子量为584,900,多糖和肽的比例为93.51:6.49。
其中多糖由鼠李糖(rhamnose)、木糖(xylose)、果糖(fructose)、半乳糖(galactose)、甘露糖(mannose)和葡萄糖以0.793:0.964:2.944:0.167:0.384:7.94比例组成,多肽的部分则由十七种胺基酸所组成。以Gl-PS处理树突细胞後,不但能加速其成熟,同时可以诱导毒杀性T细胞生成。
2004年Shao证实Gl-PS能活化小鼠的B细胞和巨噬细胞,但不能活化T细胞。该研究以细胞表面「具有TLR-4受体」与「不具TLR-4受体」的B细胞和巨噬细胞互相交互验证,再次确认灵芝多糖体是经由「与TLR-4受体结合後向胞内传递讯息」来达成调控免疫的目的。
灵芝多糖组份Gl-PS、PS-G和F3都是含有蛋白质的多糖肽,其研究来源不同,分离纯化条件各异,但无论是B细胞、巨噬细胞或树突细胞,皆是与TLR-4受体结合後开始启动免疫讯息传递,由此结果可知,此类活性多糖肽的基本构造必定有其相似之处,而过去模糊的高分子多糖体,也逐步厘清到活性多糖肽的概念。
二、三萜类
(一) 发现数种不同结构、不同活性的三萜化合物
1982年Kubota等发现灵芝G. lucidum子实体的两种新苦味成分,命名为ganoderic acid A和 B(灵芝酸A和B)。灵芝酸A分子式C30H44O7分子量516.3,是一种新型高度氧化的三萜类化合物。
1983年Toth等自灵芝G. lucidum菌丝体中分离灵芝酸T、S、R等六种新的三萜类化合物。
1990年Hirotani等发表以HPLC分析G. lucidum的菌丝体与子实体不同部位、不同生长阶段的三萜类成分变化,发现有些灵芝酸(如灵芝酸A、B、H)仅存在於子实体,而灵芝酸T、S和R则是菌丝体与子实体都有。
1998年Min等从灵芝G. lucidum孢子中分离出的十二种萜类化合物,其中ganoderiol F和ganodermanontriol被发现具有抗HIV活性,灵芝酸β、lucidumol B和ganolucidic acid A也对HIV-1蛋白酶具有抑制活性,能控制爱滋病毒的复制,在当时被认为是世纪黑死病的救星。
灵芝在不同的生活史阶段,不论是子实体、孢子或菌丝皆会产生特定的三萜类,呈现不同的生理功能。目前自灵芝G. lucidum和松杉灵芝G. taugae子实体、孢子和菌丝体所分离而得的三萜类化合物经监定者已达两百种以上,其中以四环三萜化合物为主。
在这些构造相似且皆属於高度氧化的羊毛固烷衍生物中,有的苦味很强,如酸性的三萜类化合物灵芝酸(ganoderic acid)和赤芝酸(lucidenic acid),有些则是淡而无味的。
这些灵芝特有的三萜类化合物经三十多年的药理研究结果显示具有:保肝作用、抗肿瘤、抗病毒增生、抑制组织胺释放、抑制胆固醇合成、抑制血小板聚集、抗氧化作用、抗发炎作用、治疗过敏性气喘、预防骨质疏松症、改善下泌尿道症候群等功能,成为灵芝功能性产品开发的标靶。
(二) 只存在子实体的灵芝酸A
开发含有特定三萜类组成与含量的产品,是「一定有效」的根本。以最早被发表的灵芝酸A为例,从早期的抑制组织胺释放,到後来的抗癌细胞增殖与侵袭,抑制癌细胞讯息传递作用等,已成为灵芝产品功能性指标成分之一。
由於灵芝酸A只存在子实体萃取物里,目前尚无法以人工合成方式取得,要想量产灵芝酸A就必须由大量子实体来萃取。选择灵芝酸A高产量的灵芝品种,正确的栽培与管理方式,以及适当采收时期与库存管理,都是提高产量降低成本的功课。
2016年Sakamoto等发表一种高特异性抗体(MAb12A)针对灵芝酸A进行专一性检测,其侦测极限为6 ng/mL,能够用在口服灵芝酸A後的血液里追踪其动力学的变化,也可以用於提昇灵芝产品质量控制的准确性和可靠性。
(三) 菌丝体里也有的灵芝酸T
另一种在菌丝体也大量存在,能够毒杀肝癌细胞的灵芝酸T,後续研究此灵芝酸T对於肺腺癌与子宫颈癌细胞的抑制作用时,发现它能使癌细胞的周期停滞在G1期,并可藉由降低粒线体膜电位、提高细胞内caspase-3和caspase-9的活性等机制,诱导癌细胞凋亡,成为标靶抗癌开发的选项。
灵芝酸T可以由灵芝菌丝体中萃取而得,因此开启了菌种筛选、发酵生产的制程改良、回收分离技术的提昇的竞赛。2012年Li等发表应用ADS-8树脂的回收和再利用技术,提高灵芝菌丝体粗萃取物纯化到最终灵芝酸T的回收率达72.2%,减少精制加工过程的损耗。
2012年Liu等将灵芝酸T 进行结构修饰後,产生更有效的小分子化合物,对子宫颈癌HeLa细胞的生长有更高的抑制效果,但是对正常细胞毒性更低,让灵芝酸T成为开发癌细胞增殖抑制剂的重要原料。
(四) 特定灵芝酸的量产工程
2016年Zhang等发表以基因工程来调控同源的羊毛固醇合成酶(LS)基因复制数目,以及在灵芝菌丝体中的过度表达,结果显示可以增加菌丝体中灵芝酸和羊毛固醇的的含量,成分分析证实转基因菌株灵芝酸A的含量提高3.2倍,羊毛固醇和麦角固醇的累积量也比对照菌株高2.3和1.4倍。
这项研究表明,同源合成酶基因的转殖与过度表达的诱导可以促使羊毛固醇的大量积累,作为灵芝酸生物合成时的前趋物,增加灵芝酸产量,为菌丝体来源的灵芝酸生产成本的降低做出贡献。
4.0版灵芝产品「一定有效」的特徵:
1. 具备至少一种可正确标示含量的灵芝活性成分。
2. 此活性成分的组成构造明确且能单独稳定存在。
3. 此活性成分可以工业化规格量产。
4. 此活性成分可以被标准检测方法分析、定性与定量。
5. 此活性成分有直接科学文献证明其功能。
6. 此活性成分有直接科学证据显示其作为食品原料的安全性。
延伸阅读
〔台大教授许瑞祥专文〕你吃的灵芝属於哪个世代?细说灵芝产业1.0~4.0完整版(上)
〔台大教授许瑞祥专文〕你吃的灵芝属於哪个世代?细说灵芝产业1.0~4.0完整版(下)


